Модель полинга кори биохимия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 октября 2019; проверки требуют 3 правки.
В химии, раскраска по CPK (англ. Corey-Pauling-Koltun, рус. Кори-Полинг-Колтун) — популярная схема цветового обозначения атомов различных химических элементов в молекулярных моделях. Данная схема названа в честь молекулярной модели CPK, созданной Робертом Кори и Лайнусом Полингом и усовершенствованной Уолтером Колтуном.
История[править | править код]
В 1952 году, Кори и Полинг опубликовали описание объёмной модели белков и других биомолекул, которую они создали в Калифорнийском технологическом институте.[1]
Их модель представляла атомы деревянными шариками, раскрашенными в яркие цвета, соответствующие химическим элементам. Их цветовая модель включала:
- белый для водорода
- чёрный для углерода
- голубой для азота
- красный для кислорода
Они также построили уменьшенные модели, используя пластиковые шарики такой же цветовой схемы.
В 1965 году Колтун запатентовал улучшенную версию модели Кори-Полинга.[2] В своём патенте он упоминает следующие цвета:
- белый для водорода
- чёрный для углерода
- синий для азота
- красный для кислорода
- тёмно-жёлтый для серы
- пурпурный для фосфора
- оттенки от светло- до тёмно-зелёного соответственно для галогенов (F, Cl, Br, I)
- серебряный для металлов (Co, Fe, Ni, Cu)
Типичные цветовые обозначения[править | править код]
Типичные цветовые обозначения в CPK включают:
| водород (H) | белый | |
| углерод (C) | чёрный | |
| азот (N) | синий | |
| кислород (O) | красный | |
| фтор (F), хлор (Cl) | зелёный | |
| бром (Br) | тёмно-красный | |
| иод (I) | тёмно-фиолетовый | |
| благородные газы (He, Ne, Ar, Xe, Kr) | циановый | |
| фосфор (P) | оранжевый | |
| сера (S) | жёлтый | |
| бор (B), большинство переходных металлов | бежевый | |
| щелочные металлы (Li, Na, K, Rb, Cs) | фиолетовый | |
| щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) | тёмно-зелёный | |
| титан (Ti) | серый | |
| железо (Fe) | темно-оранжевый | |
| другие элементы | розовый |
Некоторые из цветов CPK мнемонически связаны с цветами чистых элементов или их соединений. Например, водород — бесцветный газ, углерод в виде угля или графита чёрный, многие формы серы имеют жёлтый цвет, хлор — зеленоватый газ, бром — тёмно-красная жидкость, иод в эфире фиолетовый, одна из аллотропных модификаций фосфора имеет красный цвет, железная ржавчина имеет тёмно-оранжевый оттенок, и т. д. В случае других элементов, таких как кислород и азот, выбор цвета менее понятен. Вероятно, красный цвет для кислорода был выбран потому что он часто ассоциируется с горением, а голубой цвет для азота обусловлен тем, что это главный компонент земной атмосферы, имеющей голубой оттенок.
Современные варианты[править | править код]
Следующая таблица представляет собой цвета, назначаемые каждому элементу в популярных компьютерных программах. Колонка C содержит изначальные цвета Кори и Полинга,[1] колонка K содержит цвета из патента Колтуна.[2] Колонка J описывает цветовую схему, используемую молекулярным визуализатором Jmol.[3] Колонка R описывает цветовую схему, используемую программой RasMol; в случае если указаны два цвета, второй актуален для версий 2.7.3 и выше.[3][4] Все цвета даны приблизительно и могут зависеть от дисплея и настроек видео.
Примечания[править | править код]
- ↑ 1 2 Robert B. Corey and Linus Pauling (1953): Molecular Models of Amino Acids, Peptides, and Proteins. Review of Scientific Instruments, Volume 24, Issue 8, pp. 621—627. doi:10.1063/1.1770803
- ↑ 1 2
Walter L. Koltun (9165), Space filling atomic units and connectors for molecular models. U. S. Patent 3170246. - ↑ 1 2
Jmol color table на sourceforge.net. - ↑
Rasmol color table Архивировано 13 мая 2001 года. на bio.cmu.edu.
Ссылки[править | править код]
- What is the basis for the CPK color scheme? Which colors is used for which atom?
- Physical Molecular Models
- Модель Кори-Полинга-Колтуна: стандарт «молекулярного конструктора»
Источник
Рентгеноструктурная
кристаллография решает две главные проблемы белковой химии: закономерности
чередования последовательности аминокислотных остатков в полипептидной цепи и
закономерности конфигурации белковой молекулы.
Первые
рентгенограммы белков, полученные еще в 30-х годах У. Астбю-ри, а затем Л.
Полингом и Р. Кори, позволили установить наличие в белках наряду с линейной
полипептидной цепью участков, определенным образом скрученных.
Под вторичной
структурой белка подразумевают конфигурацию полипептидной цепи, т. е. способ
свертывания, скручивания (складывание, упаковка) полипептидной цепи в
спиральную или какую-либо другую конформацию. Процесс этот протекает не
хаотично, а в соответствии с программой, заложенной в первичной структуре.
Подробно изучены две основные конфигурации полипептидных цепей, отвечающих
структурным требованиям и экспериментальным данным: α-спирали и
β-структуры.
Благодаря
исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков
принято считать α-спираль (рис. 1.17). Закручивание полипептидной цепи
происходит по часовой стрелке (правый ход спирали), что обусловлено
L-аминокислотным составом природных белков. Движущей силой в возникновении
α-спиралей (так же как и β-структур) является способность аминокислот
к образованию водородных связей. В структуре α-спиралей открыт ряд
закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных
остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, а на один
аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26°, через 5
витков спирали (18 аминокислотных остатков) структурная конфигурация
полипептидной цепи повторяется. Это означает, что период повторяемости (или
идентичности) α-спиральной структуры составляет 2,7 нм.
Для каждого
белка характерна определенная степень спирализации его полипептидной цепи.
Степень спирализации устанавливают путем измерения удельного вращения плоскости
поляризованного света. Изменение последнего
находится в прямой зависимости от степени спирализации белковой молекулы. Не
все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В
молекуле белка α-спиральные участки чередуются с линейными. В частности,
если α- и β-цепи гемоглобина спирализованы,
например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%.
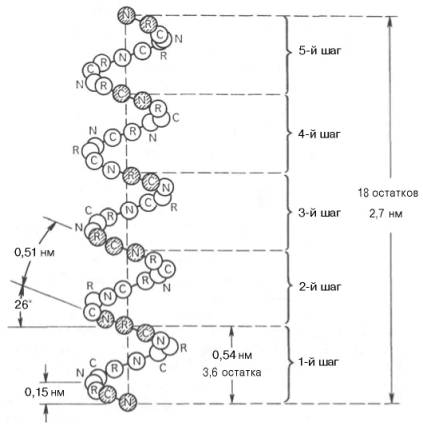
Рис. 1.17. Структура
и параметры α-спирали.
Таким
образом, стабильность вторичной структуры обеспечивается в основном водородными
связями (определенный вклад вносят и главно-валентные связи – пептидные и
дисульфидные).
Водородная
связь представляет собой слабое электростатическое притяжение (взаимодействие,
связь) между одним электроотрицательным атомом (например, кислородом или
азотом) и водородным атомом, кова-лентно связанным со вторым
электроотрицательным атомом. Типы водородных связей представлены далее.
По
современным представлениям, водородная связь включает не только
электростатические силы притяжения между полярными группами (взаимодействие
атомов водорода с электроотрицательными элементами: кислородом, азотом,
хлором), но и электронные связи такого же типа, как в ряде комплексных
соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью.
Так, если для разрыва химических межатомных связей необходимо затратить от 84
до 8400 кДж, то для разрыва одной водородной связи требуется затратить всего
лишь 6,3 кДж на 1 моль. Поскольку в белковой молекуле число водородных связей
очень велико (в образование водородных связей вовлечены все пептидные группы),
они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру,
сообщая ей компактность и стабильность.
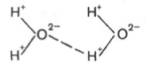
Механизм
возникновения водородных связей в элементарной форме может быть представлен на
примере взаимодействия двух молекул воды (диполи). В диполе воды, как известно,
избыток положительных зарядов приходится на атомы водорода, а избыток
отрицательных – на атомы кислорода.

Благодаря
особенностям строения атома водорода при достаточном сближении двух молекул
воды возникает электростатическое взаимодействие между атомом кислорода одной
молекулы и атомом водорода второй молекулы воды. Следствием этого является
ослабление связи между атомами водорода и кислорода в каждой молекуле воды и
соответственно возникновение новой, непрочной связи (отмечена пунктиром) между
атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту
непрочную связь принято обозначать водородной связью.
В белковой
молекуле наиболее важные водородные связи образуются между ковалентно связанным
атомом водорода, несущим частичный положительный заряд, и отрицательно
заряженным ковалентно связанным атомом кислорода. Ниже представлены примеры
водородных связей в белковой молекуле: а) между пептидными цепями; б) между
двумя гидрок-сильными группами; в) между ионизированной СООН-группой и
ОН-груп-пой тирозина; г) между ОН-группой серина и пептидной связью.
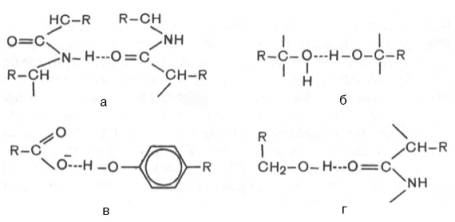
В зависимости
от химической природы атома-акцептора водородные связи отличаются друг от друга
степенью прочности. О количестве водородных связей в белковой молекуле судят по
данным изотопного метода, в частности по времени обмена атомов водорода,
участвующих в образовании водородной связи, на дейтерий (при обработке белка
тяжелой водой D2O, в которой
вместо обычного водорода содержится его тяжелый изотоп дейтерий).
Другой тип
конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в
других фибриллярных белках, получил название β-структуры. В этом случае
две или более линейные полипептидные цепи, расположенные параллельно или, чаще,
антипараллельно, прочно связываются межцепочечными водородными связями между NH-и
СО-группами соседних цепей, образуя структуру типа складчатого слоя (рис.
1.18).
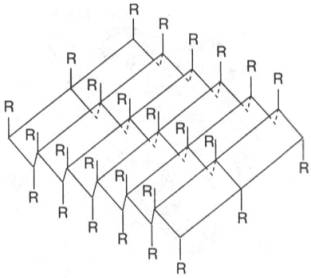
Рис. 1.18. β-Структура полипептидных цепей.
В природе
существуют белки, строение которых, однако, не соответствует ни β-, ни
α-структуре. Типичным примером таких белков является коллаген –
фибриллярный белок, составляющий основную массу соединительной ткани в
организме человека и животных (см. главу 21).
Методами
рентгеноструктурного анализа в настоящее время доказано существование еще двух
уровней структурной организации белковой молекулы, оказавшихся промежуточными
между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены.
Надвторичные
структуры представляют собой агрегаты полипептидных цепей, обладающих
собственной вторичной структурой и образующихся в некоторых белках в результате
их термодинамической или кинетической стабильности. Так, в глобулярных белках
открыты (βхβ)-элементы (представлены двумя параллельными
β-цепями, связанными сегментом х), βαβαβ-элементы
(представлены двумя сегментами α-спирали, вставленными между тремя
параллельными β-цепями) и др. В больших глобулярных белках иногда
содержатся неодинаковые структурные домены, выполняющие разные функции, как и
однотипные домены в пределах одного мономерного белка, образующиеся, вероятнее
всего, как результат влияния генов в первом случае или дупликации генов – во
втором. Домены создаются объединением и чередованием α-спиралей и
β-слоев, между которыми открываются более рыхлые структуры (рис. 1.19).
Домен –
это компактная глобулярная структурная единица внутри полипептидной цепи.
Домены могут выполнять разные функции и подвергаться складыванию (свертыванию)
в независимые компактные глобулярные структурные единицы, соединенные между
собой гибкими участками внутри белковой молекулы. Открыто много белков
(например, иммуноглобулины), состоящих из разных по структуре и функциям доменов,
кодируемых разными генами.
Еще по теме:
- Вторичная структура белка – биохимический справочник
- Вторичные структуры белков – Наглядная биохимия
Источник
МОДЕЛИ ПОЛИПЕПТИДОВ ПОЛИНГА И КОРИ [c.21]
Вскоре появляется знаменитая серия работ Л. Полинга и Р. Кори (1951 г.), в которых авторы рассмотрели все ранее известные структурные модели полипептидов, в том числе предложенные Брэггом, Кендрью и Перутцем, и отвергли их. Вместо них они предложили две новые низкоэнергетические регулярные пространственные формы – а-спираль и р-складчатый лист. Один виток а-спирали включает 3,6 аминокислотных [c.70]
Первое краткое сообщение о результатах исследования Полингом и Кори пространственной структуры полипептидов и белков появилось в ноябре 1950 г. [57]. В апреле следующего года в одном номере журнала было опубликовано сразу восемь работ Полинга и Кори с подробным изложением полученных результатов, а вскоре появились еще четыре их работы [58—65]. Они сразу же обратили на себя внимание научной общественности, вызвали огромный резонанс и оказали сильное влияние на последующее развитие молекулярной биологии и прежде всего исследований пространственной структуры пептидов и белков. В связи с чем вполне обоснованно разделить исследования, проводимые в этой области, на работы до 1951 г. и последующего периода. Читая какой-либо труд, посвященный структуре пептидов, можно, не зная даты публикации, почти наверняка определить, написан ли он до или после появления в печати работ этих ученых. Исследования Полинга и Кори (1951 г.) имеют теоретический характер. Сделанные авторами предсказания возможных структур полипептидной цепи основаны на следующих постулатах 1) приняты одинаковые значения для длин связей и валентных углов всех пептидных групп полипептидной цепи. В литературе они получили название геометрических параметров Полинга— Кори 2) пептидная группа считалась плоской. Возможны две плоские конфигурации группы, отличающиеся взаимным расположением связей N—Н и С=0, цис- и трамс-переход между ними связан с преодолением высокого потенциального барьера (-20 ккал/моль). При построении моделей Полинг и Кори отдали предпочтение транс-конфигурации пептидной группы. По оценке Р. Кори и Дж. Донахью, отклонение от плоского строения группы на 10° вызывает повышение энергии приблизительно на 1,5, а на 30° — на 6 ккал/моль [66] 3) предполагалась полная насыщенность полипептидной цепи водородными связями. Для водородной связи N—Н…О = С были приняты следующие геометрические и энергетические оценки расстояние N…0 считалось равным 2,8 А, максимальное отклонение от линейности N—Н…0 не должно превышать 30° и энергия связи — 8,0 ккал/моль 4) при построении моделей пептидной цепи выбирались наиболее благоприятные ориентации пептидных групп, разделенных атомом С , с учетом потенциалов внутреннего вращения вокруг связей С —N и С —С и ван-дер-ваальсовых контактов между атомами 5) конформационные состояния всех звеньев пептидной цепи считались эквивалентными. [c.21]
Кори нашли, что все они не удовлетворяют приведенным требованиям и должны быть отвергнуты. Авторы предложили две новые структуры (а и у) и структуру складчатого листа (Р). Как известно, до работ Полинга и Кори было разработано большое число молекулярных моделей полипептидов, а Брэгг, Кендрью и Перутц проанализировали этот вопрос в общем виде и как будто предусмотрели все возможные варианты. Как же в таких случаях удалось предложить совершенно новые структуры Это объясняется двумя обстоятельствами. Одно из них связано с более жесткими требованиями, предъявленными Полингом и Кори к геометрии полипептидов другое, сыгравшее решающую роль, — с предположением о реализации спиралей с нецелочисленными винтовыми осями симметрии. Во всех предпринимавшихся ранее поисках структур полипептидов использовались элементы симметрии атомных и низкомолекулярных кристаллов. В этом случае винтовые оси, действительно, могут быть только целочисленными. По отношению к отдельной макромолекуле требование, чтобы спираль содержала только целое число аминокислотных остатков на виток, не может быть оправдано соображениями физического порядка. Использование до Полинга и Кори целочисленных винтовых осей – результат автоматического перенесения кристаллографического принципа симметрии на спиральные полимерные объекты, т.е. в область, где он не работает. [c.22]
В первых моделях пространственного строения белковых молекул водородная связь служила главным стабилизирующим фактором. Молекулы фибриллярных белков представлялись слоистыми структурами, а молекулы глобулярных белков – пакетом слоистых структур, состоящих или из плоских пептидных цепей, скрепленных водородными связями, или из свернутых, регулярных цепей, также стабилизированных внутренними водородными связями. Отклонение от регулярности, повороты цепей и нарушение оптимальных условий образования внутримолекулярных водородных связей допускались лишь в местах аминокислотной последовательности, где находятся остатки пролина. Среди тех, кто считал водородную связь не только главной, но и единственной упаковочной силой, был М. Хаггинс [10, 11]. Все предложенные им структуры полипептидов были полностью насыщены водородными связями. Этот же принцип был положен в основу конструирования пептидных моделей Л. Брэггом, Дж. Кендрью и М. Перутцем [12], а также а-спирали и -структуры складчатых листов Л. Полингом и Р. Кори [1,2]. [c.233]
Может ли полипептидная цепь быть уложена в структуру, состоящую из регулярно повторяющихся участков Чтобы ответить на этот вопрос, Полинг и Кори сравнили ряд потенциально возможных конформаций полипептидов, построив их точные молекулярные модели. При этом строго соблюдались экспериментально установленные для аминокислот и небольших пептидов величины углов связей и межатомных расстоя= ний. В 1951 г. они предложили две периодические полипептидные структуры, названные соответственно о -спираль и р-складчатый слой. [c.34]
Под конформацпоннымн превращениями в макромолекулах до самого недавнего времени понимали превращения (переходы) спираль — клубок в полипептидах и нуклеиновых кислотах. Предполагалось, что, в отличие от макромолекул нативных белков, нуклеиновых кислот и их синтетических моделей — полипептидов и полинуклеотидов, где внутримолекулярные взаимодействия (в основном, водородные связи) обеспечивают наличие вторичной структуры, внутримолекулярные силы у обычных синтетических поли.меров недостаточны для поддержания уиорядоченности в цепи. Макро.молекулы первых существуют в растворах в конформации одионитевых (белки, полипептиды) или двунитевых (нуклеиновые кислоты, полинуклеотиды) спиралей (см. [251, 510]). Двойная спираль Крика — Уотсона [511] для дезоксирибонуклеиновой кислоты и а-сиираль Полинга — Кори [512] для полипептидов — наиболее известные примеры вторичной молекулярной структуры. Макромолекула в спиральной конформации подобна по своей структуре одномерному кристаллу. Изменением температуры или других условий (состав смешанного растворителя, pH растворителя — [c.252]
При поиске решения структурной проблемы белка особенно вдохновляющими примерами явились результаты теоретических исследований Л. Полинга и Р. Кори регулярных структур полипептидов [53] и Дж. Уотсона и Ф. Крика двойной спирали ДНК [54]. В этих работах с помощью простейшего варианта конформационного анализа – проволочных моделей, получивших позднее название моделей Кендрью-Уотсона, а также ряда экспериментальных данных, прежде всего результатов рентгеноструктурного анализа волокон (в случае ДНК еще и специфических соотношений оснований Э. Чаргаффа), удалось предсказать наиболее выгодные пространственные структуры полимеров. Собственно, предсказана была как в случае пептидов, так и нуклеиновых кислот, геометрия лишь одного звена, которое в силу регулярности обоих полимеров явилось трансляционным элементом. Белок же – гетерогенная аминокислотная последовательность, и поэтому таким путем предсказать его трехмерную структуру нельзя. Но то обстоятельство, что простейший, почти качественный, конформационный анализ привел к количественно правильным геометрическим параметрам низкоэнергетических форм звеньев, повторяющихся в гомополипептидах и ДНК, указывало на большие потенциальные возможности классического подхода и его механической модели в описании пространственного строения молекул. [c.108]
На рис. 54 приведены данные по оптическому вращению (для О-линии натрия) олигомеров у-метил-Ь-глутамата в четырех растворителях. Поведение полипептида в дихлоруксусной кислоте — растворителе, способствующем образованию конформации статистического клубка,— такое, которого следует ожидать для конфигурационной оптической активности, т. е. вращение постепенно приближается к асимптоте, когда п очень велико. Было обнаружено, что для нескольких изученных высокомолекулярных поли-у-метил-Ь-глутаматов средняя величина [а] приблизительно равна —33°, что очень близко к ожидаемой предельной величине [0)1) на рис. 54, а (Доти и Янг, неопубликованные данные). Совершенно другая картина на рисунках 54, б—г, на которых удельное вращение проходит через минимум, соответствующий пентамеру, и затем становится положительным при высоких СП. Из ранних работ Доти, Блоута с сотр. [30, 31 ] известно, что диметилформамид, л-крезол и диоксан — растворители, способствующие образованию конформации а-спирали. В соответствии с моделью а-спирали, предложенной Полингом и Кори, на виток спирали приходится 3,6 остатка и первая водородная связь образуется внутримолекулярно между первым и пятым остатками. Таким образом, результаты, приведенные на рис. 54, можно интерпретировать в терминах образования а-спирали для пентамера и высших гомологов. О диоксане также известно, что он вызывает ассоциацию молекул и появление так называемой Р-формы у полипептидов низкого молекулярного веса (раздел Г-7). Гудман и др. пришли к выводу о том, что данные, приведенные на рисунке 54, г, являются результатом одновременного влияния внутримолекулярных водородных связей и межмолекулярной ассоциации. [c.101]
В 1950 г., за несколько месяцев до опубликования серии исследований Л. Полинга и Р. Кори, появилась большая работа Л. Брэгга, Дж. Кендрью и М. Перутца [56], которая как бы подвела черту под структурными исследованиями белков и полипептидов начального периода. В этой работе анализируются структурные модели Астбери, Хаггинса, Цана и других авторов и предлагается ряд новых моделей. Однако, по-прежнему, речь идет о возможных типах укладки основной пептидной цепи. Авторы также рассматривают свои первые результаты рентгеноструктурного изучения гемоглобина и миоглобина. При анализе возможных структур пептидного остова Брэгг, Кендрью и Перутц принимают геометрические параметры пептидной группы, близкие к параметрам Хаггинса и согласующиеся с более поздними данными Кори. Так, длина связи С -С считается равной 1,52 А, С -М – 1,36 А и С =0 – 1,24 А. Валентные углы при атоме С приняты тетраэдрическими (109°28 ), а при атоме N – или тетраэдрическими, или тригональными (120°). Длина водородной связи М-Н…С=0 составляет 2,85 А. Ее направленность строго не лимитируется, но авторы по мере возможности стремятся к линейному расположению связей К-Н и С=0. Л. Брэгг, Дж. Кендрью и М. Перутц приняли постулат М. Хаггинса о спиральной симметрии полипептидной цепи с целочисленным порядком винтовой оси, но отвергли его второй постулат о том, что каждый элемент основной цепи должен находиться в одинаковых отношениях с соседними элементами (принцип эквивалентности). Так же как и Хаггинс, они придают огромное значение водородной связи М-Н…С = 0 в формировании структуры основной цепи и считают наиболее стабильными только те из них, которые полностью насыщены ими. Предложенная авторами классификация спиральных структур является общепризнанной и в настоящее время [56]. В основу ее положено разделение структур по симметрии пептидного остова и размеру циклов с водородными связями. [c.19]
Картер и Краут показали, что весьма распространенная вытянутая конформация полипептидных цепей (р-складчатая структура по Полингу и Кори) соответствует стабильной правозакрученной двойной спирали, т. е. существует двойная полипептидная спираль. Ее шаг и радиус примерно такие же, как и у двойной спирали нуклеиновых кислот. Авторы весьма тщательно построили пространственные молекулярные модели и увидели, что полипептидная двойная спираль в точности комплементарна двойной спирали РНК, причем полипептидная двойная спираль точно входит в малую бороздку двойной спирали РНК. В результате образуются водородные связи между 2 -0Н Группами рибозы (что, по-видимому, и объясняет особые свойства РНК, у ДНК нет этого гидроксила) и кислородом карбонила пептидной связи. Авторы отмечают, что такую точную комплементарность ста- бильных конформаций РНК и полипептидов вряд ли можно считать простым совпадением. Они предположили, что обе эти двойные спирали взаимно катализировали сборку друг друга из активированных предшественников на ранних стадиях эволюции. В самом деле, комплементарное соответствие двух двойных спиралей представляется весьма важным, но оно обеспечивает ускорение синтеза лишь основных каркасов — полипептидного и полинуклеотидного, тогда как для преодоления обсуждаемого нами кризиса на начальной стадии биологической эволюции необходимо установление полного однозначного соответствия определенных аминокислотных и нуклеотидных радикалов. Для этого нужно, чтобы взаимная полимеразная активность поли- [c.59]
Источник
