Метформин камни в почках

Илья: Можно ли принимать метформин с одной почкой (вторая удалена при онкологии)?
Илья, здравствуйте! Окончательный ответ на вопрос о возможности приема метформина при наличии одной почки должен вам дать врач-нефролог, у которого вы наблюдаетесь. Я лишь могу ознакомить вас с результатами исследований о влиянии метформина на почки, а также процитировать мнения некоторых специалистов.
Основная опасность приема метформина пациентами с почечными заболеваниями – это риск развития лактоацидоза (лактатацидоза) – крайне опасного осложнения, в результате которого происходит закисление организма молочной кислотой, отчего больной может умереть. Поэтому, для снижения рисков его развития, пациентам с болезнями прчек рекомендуют скорректировать или вообще отменить прием некоторых лекарств.
Некоторые лекарственные препараты следует принимать с осторожностью в зависимости от оставшегося уровня функции почек. Это называется «почечное дозирование» и относится ко всем лекарствам, которые фильтруются (выводятся) почками (это различные группы лекарственных препаратов, применяемых при сахарном диабете, для снижения уровня холестерина, при болезнях сердца и т.д.).
 Метформин следует осторожно принимать при заболеваниях почек
Метформин следует осторожно принимать при заболеваниях почек
Онкологам, специализирующимся на лечении рака почек, следует учитывать этот при назначении лекарственных препаратов, в том числе метформина. Некоторые рецептурные препараты являются нефротоксичными или вредным для почек. К ним относятся нестероидные противовоспалительные препараты, а также некоторые типы обезболивающих, к которым относятся ибупрофен, аспирин и напроксен.
Метформин не относится к нефротоксичным препаратам, но его следует принимать с осторожностью пациентам со сниженной функцией почек.
Если у вас одна функционирующая почка, вам следует внимательно читать инструкции к лекарственным препаратам, которые вы пронимаете, чтобы исключить их токсичное действие на почки.
В исследовании «Применение метформина пациентами с почечными и сердечно-сосудистыми заболеваниями» (PubMed, PMCID: PMC3263972) сказано следующее: «После нескольких лет использования и обширного анализа различных научных отчетов, прием метформина пациентами с заболеваниями почек представляется безопасным при условии корректировки его дозы, исходя из сохраненной функции почек. Прием метформина следует прекратить больным со скоростью клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м². Таким образом, метформин нужно назначать с осторожностью больным с хронической почечной недостаточностью (ХПН), которые подвержены риску развития сердечно-сосудистых заболеваний».
Вот что пишет д-р Джон Мерендино, руководитель отделения эндокринологии в больнице Джона Хопкинса (США):
«Прием метформина несет низкий риск развития лактацидоза – очень серьезного побочного осложнения. Молочная кислота накапливается в мышечных клетках, а почки должны выводить молочную кислоту из организма, иначе она накапливается в крови. Когда молочной кислоты становится слишком много, у человека развивается молочнокислый ацидоз. Симптомы его следующие: ненормальное дыхание, тошнота и рвота, боли в животе, спутанное сознание. Заболевание легко поддается лечению, если обнаружено на ранней стадии, но оно может привести к повреждению почек и даже смерти, если вовремя не предприняты соответствующие меры.
Метформин увеличивает выработку молочной кислоты. Если почки работают должным образом, это не является проблемой. Тем не менее, у людей, которые имеют заболевания почек, и, как правило, повышенный уровень креатинина, метформин повышает риск развития молочнокислого ацидоза, так что этой группе больных не следует использовать данный препарат.
В других ситуациях, когда функция почек может быть снижена, например, у людей, страдающих сердечной недостаточностью или принимающих диуретики, врач может порекомендовать прекратить использование метформина.
Красители для внутривенного введения, применяемые при некоторых рентгеновских исследованиях, также могут привести к повреждению почек. Поэтому обычная рекомендация – прекратить прием метформина на срок от 24 до 48 часов до и после проведения рентгена, до тех пор, пока не станет ясно, что почки не пострадали.
Некоторые врачи не решаются назначать метформин пожилым людям, как правило, старше 80 лет, потому что они нередко имеют дисфункции почек и склонны к обезвоживанию организма. Прием метформина может еще более усугубить работу почек у этой группы пациентов.
Обратите внимание на важный момент: больные, узнавшие о риске развития лактатацидоза при приеме метформина, нередко отказываются от него, мотивируя это тем, что «метформин вреден для почек». Это не верно.
Метформин не вызывает повреждения почек, он просто не должен применяться теми пациентами, у которых уже есть повреждения почек, возникшие по какой-то другой причине, например, из-за диабета или высокого артериального давления».
В соответствии с последними рекомендациями американского Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), врачи должны проверять СКФ (скорость клубочковой фильтрации) у пациентов перед назначением метформина. Если СКФ ниже 30 мл/мин на 1,73 м 2 – это определяется как почечное заболевание, при котором назначение метформина противопоказано.
Также отмечается, что метформин может быть назначен, если СКФ составляет от 45 до 60 мл / мин на 1,73 м 2 – то есть, при легкой форме хронической болезни почек. Когда СКФ снижается до 30-45 мл / мин, что является умеренной формой заболевания, FDA рекомендует врачам надлежащим образом оценивать соотношения риска и пользы приема метформина перед принятием решения об его отмене или продолжении лечения.
Национальный институт здравоохранения и совершенства медицинской помощи Великобритании (NICE) советует не назначать метформин, если СКФ <45 мл/мин на 1,73 м 2.
Также, необходимо отметить, что все пациенты, принимающие метформин, должны проверять свои почки на скорость клубочковой фильтрации, по крайней мере, раз в год. Пожилые люди и другие больные, имеющие повышенный риск нарушения функции почек, должны проверять СКФ еще чаще (раз в 3 месяца или раз в полгода).
Резюме
- Метформин не является нефротоксичным препаратом, но его следует принимать с осторожностью пациентами с нарушенной функцией почек.
- Пациентам с заболеваниям почек, а также больным с одной действующей почкой, метформин принимать можно, если скорость клубочковой фильтрации выше 30 мл/мин на 1,73 м2. Решение о назначении метформина или о его отмене должен принимать врач-нефролог, а не сам больной и только после изучения данных о СКФ пациента.
- Если прием метформина все-же одобрен пациенту с нарушенной функцией почек, он должен не реже 1 раза в год (возможно даже чаще) проверять СКФ почек. При ее снижении прием метформина должен быть отменен.
DiaGid.ru, 24.02.2017.
Источник
В статье приведены результаты исследования влияния метформина на функцию почек у пациентов с сахарным диабетом 2-го типа на инсулинотерапии
Введение
Сахарный диабет (СД) 2-го типа и его почечное микрососудистое осложнение – диабетическая нефропатия (ДН) являются самостоятельными факторами риска развития сердечно-сосудистых катастроф [1]. Несмотря на большое количество исследований, изучающих влияние различных сахароснижающих препаратов на сердечно-сосудистые исходы, метформин пока является единственным среди них, убедительно продемонстрировавшим в крупных эпидемиологических исследованиях способность уменьшать риск развития макрососудистых осложнений СД 2-го типа [2, 3].
Плейотропные сердечно-сосудистые эффекты метформина отчасти обусловлены его способностью уменьшать инсулинорезистентность, избыточный вес, дислипидемию, улучшать реологические свойства крови, ослаблять проявления эндотелиальной дисфункции и оксидативного стресса [4]. Несмотря на то, что описанным нарушениям отводится важная роль и в патогенезе ДН [1, 4], данные о влиянии метформина на почечную функцию при СД 2-го типа не столь однозначны. Так, длительное время применение метформина у пациентов с умеренно сниженной функцией почек (клиренс креатинина < 60 мл/мин) было ограничено из-за необоснованного мнения об увеличении риска развития лактат-ацидоза [5]. В настоящее время уровнем официально допустимого клиренса креатинина при первичном назначении препарата является ≥ 45 мл/мин [6].
Несмотря на то, что результаты ряда крупных клинических исследований не показали значимого влияния метформина на проявления ДН при назначении в качестве монотерапии СД 2-го типа в дебюте заболевания [7–9], в последнее десятилетие стали появляться экспериментальные доказательства возможного наличия у метформина нефропротективного потенциала за счет уменьшения процессов воспаления, а также глико- и липооксидации в почечных структурах [10–12]. Учитывая высокую частоту использования инсулинотерапии при СД 2-го типа [1, 13], важно оценить эффекты комбинации инсулинотерапии и метформина на почечную функцию, в т. ч. с использованием показателей, которые мало зависят от изменения массы тела, ожидаемого на терапии метформином [2–4, 7–9].
Материал и методы исследования
Исследование было одобрено локальным этическим комитетом, проводилось в соответствии с Хельсинкской декларацией. Все участники подписывали информированное согласие.
В исследование включались мужчины и женщины европеоидной расы в возрасте от 45 до 70 лет с СД 2-го типа, получающие терапию инсулином (в базис-болюсном или базал-плюс режиме) в суточной дозе до 0,5 ед/кг и с уровнем гликированного гемоглобина (HbA1c), липидов крови и цифрами АД не выше 10% от индивидуальных целевых значений, с отсутствием тяжелых микрососудистых осложнений заболевания, СКФ ≥ 60 мл/мин/1,73 м2 и альбуминурией < 200 мг/л.
Критериями невключения в исследование были: гиперчувствительность к компонентам, входящим в состав таблетки метформина, лактат-ацидоз в анамнезе, выраженная печеночная патология, любые острые состояния, первично-почечная патология недиабетического генеза, анемия средней и тяжелой степени, применение нефротоксичных препаратов менее чем за 6 мес. до начала исследования, регулярный прием НПВП, тяжелая сопутствующая сердечно-сосудистая патология, системные и онкологические заболевания, терапия иммуносупрессорами.
Участникам исследования были даны рекомендации по соблюдению прежнего водно-солевого режима и режима физической активности. Клиническое обследование пациентов включало анализ жалоб и истории заболевания, осмотр, измерение АД, тощакового и постпрандиального уровня глюкозы крови, расчет индекса массы тела (ИМТ).
В исследование было включено 46 пациентов с СД 2-го типа, рандомизированных в соотношении 1:1 получать дополнительно к инсулину терапию метформином в дозе 1500 мг/сут или продолжать монотерапию инсулином в течение последующих 6 мес.
Ежемесячно осуществлялся телефонный опрос пациентов, при необходимости проводилась коррекция доз и режима введения инсулина. В течение этого времени была оценена динамика показателей углеводного обмена: тощаковая и постпрандиальная гликемия, HbA1c (с использованием ВЭЖХ на анализаторе Bio Rad d10 (США)). Фиксировались частота развития гипогликемических эпизодов (симптоматически и/или при снижении гликемии <3,9 ммоль/л) и изменение дозы инсулина. Оценивалась динамика показателей липидного обмена (общий холестерин, триглицериды), цистатин С и креатинин сыворотки, уровни альбумина и креатинина в утренней порции мочи (с расчетом альбумин-креатининового соотношения (АКС)), определяемых с использованием реактивов и анализатора Cobas Integra 400 plus фирмы Rochе (Германия). На основании полученных значений рассчитывались показатели рСКФ по креатинину (рСКФкр) по формуле Кокрофта – Голта [6, 14], рСКФкр и рСКФ по цистатину С (рСКФцис) по формуле CKD-EPI [15].
Статистическая обработка полученных данных проводилась с использованием пакетов статистических программ Statistica 6.0 (StatSoft, США) и SPSS 20.0 (SPSS Inc., США) с использованием непараметрических тестов (Уилкоксона, Манна – Уитни); для сравнения распределения качественных признаков использовался критерий χ2; связь динамики показателей оценивалась с помощью коэффициента ранговой корреляции Спирмена. Значимыми считались различия при уровне р < 0,05.
Результаты и их обсуждение
43 пациента завершили исследование (21 – в группе терапии инсулином (ИГ) и 22 – в группе комбинированной терапии инсулином и метформином (МИГ)).
Клиническая характеристика сравниваемых групп
Сравниваемые группы были сопоставимы по половозрастным характеристикам и антропометрическим показателям: в группе ИГ средний возраст пациентов, 42,9% которых являлись мужчинами, составил 60,05±6,13 года, ИМТ – 31,6±4,3 кг/м2, в группе МИГ – 45,5% (р = 0,86), 60,14±5,95 года (р = 0,75) и 32,0±3,1 кг/м2 (р = 0,59), соответственно. Стаж СД 2-го типа c момента выявления заболевания в обеих группах в среднем составил 10 лет (в ИГ – 10,52±4,84 года, в МИГ – 9,7±3,6 года, р = 0,35). Абсолютное большинство пациентов, у которых была артериальная гипертензия (ее распространенность составила около 70% в обеих сравниваемых группах), получали различные группы блокаторов ренин-ангиотензин-альдостероновой системы (в группе ИГ – 76,2% пациентов, в группе комбинированной терапии – 63,6%, р = 0,37). Все пациенты с ДН в стадии альбуминурии (ХБП, стадия А2), распространенность которой в группе терапии инсулином была несколько выше (в ИГ – 57,1%, в МИГ – 42,9%, р = 0,88), получали нефропротективную терапию иАПФ или сартанами. Из других хронических осложнений СД 2-го типа наиболее часто выявлялась диабетическая дистальная полинейропатия нижних конечностей (в ИГ – у 81,0%, в МИГ – у 77,3% пациентов, р = 0,77). Непролиферативная стадия диабетической ретинопатии была зарегистрирована в 38,1% случаев в группе ИГ и в 31,8% – в группе МИГ, р=0,69. Сердечно-сосудистые события в анамнезе, такие как стабильная стенокардия до II функционального класса, более 6 мес. назад перенесенные ОКС, инфаркт миокарда, ОНМК, а также атеросклероз магистральных артерий без гемодинамически значимых стенозов и т. п., также несколько чаще выявлялись в группе пациентов, рандомизированных продолжать инсулинотерапию (52,4% против 45,5% в группе комбинированного лечения, р = 0,65). Почти все пациенты с анамнезом сердечно-сосудистых заболеваний получали терапию статинами. Курильщики также преобладали в группе ИГ (33,3%) по сравнению с группой МИГ (22,7%, р = 0,44).
Полученные данные в целом не противоречат результатам проводимых скрининговых исследований в РФ, свидетельствующих о наибольшей распространенности у пациентов с СД 2-го типа диабетической нейропатии, причем уже на стадии нормальной экскреции альбумина с мочой, и высоком проценте выявления стадии микроальбуминурии (до 40%) при длительности СД 2-го типа не менее 10 лет [1]. Стоит также отметить, что большинство пациентов с альбуминурией > 20 мг/л имели микрососудистые изменения на глазном дне, что косвенно свидетельствует о диабетическом генезе почечной дисфункции, подтверждая системность поражения микроциркуляторного русла при СД 2-го типа [1].
Динамика показателей компенсации углеводного обмена и метаболического статуса
Сравниваемые группы были сопоставимы по основным параметрам, характеризующим метаболический статус и состояние углеводного обмена (табл. 1). В обеих группах более низкие показатели общего холестерина (ОХ) и триглицеридов (ТГ) отмечались у пациентов с анамнезом сердечно-сосудистой патологии, поскольку данная когорта имела более жесткие критерии целевых показателей липидограммы и получала липидснижающую терапию.
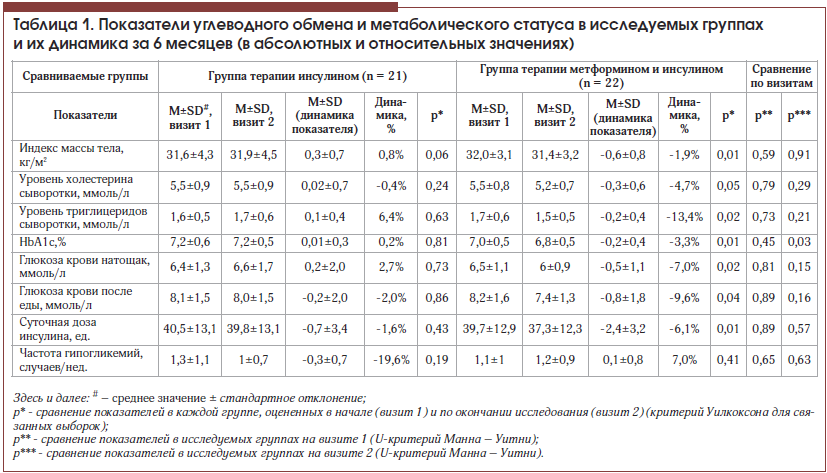
В ходе исследования у пациентов, рандомизированных в группу продолжения прежней терапии инсулином (ИГ), не произошло значимого изменения оцениваемых показателей. Тем не менее коррекция режима введения инсулина даже в пределах прежней дозы без существенного ее изменения (снижение на 1,6±7,8%, р = 0,43) привела к существенному сокращению частоты гипогликемических эпизодов почти на 20%, которое, однако, оказалось незначимым. Эти данные свидетельствуют о важности частого взаимодействия эндокринолога и пациента с СД 2-го типа даже при подобранной дозе инсулина, а также подтверждают тот факт, что режим введения инсулинотерапии (распределение доз в течение суток, необходимость выдерживания разных по длительности интервалов перед едой после введения коротких/ультракоротких инсулинов и в зависимости от уровня гликемии, рекомендации по частой смене мест введения инсулина и т. п.), а не только доза инсулина способствуют достижению компенсации заболевания.
В группе пациентов, которым к инсулинотерапии был добавлен метформин (МИГ), произошло значимое снижение массы тела, уровня ТГ, показателей гликемии и гликированного гемоглобина при одновременном уменьшении потребности в инсулине (табл. 1). Кроме того, близким к значимому оказалось снижение уровня ОХ. Полученные данные подтверждают известные позитивные свойства препарата в отношении преодоления инсулинорезистентности, абдоминального ожирения и дислипидемии, продемонстрированные в клинической практике [3, 8, 9, 16–18].
Динамика показателей почечной функции
Результаты исследования функции почек и динамики АД приведены в таблице 2. Сравниваемые группы были сопоставимы по уровням значений основных показателей почечной функции, оцениваемых в рутинной диабетологической практике. Между тем внутри группы обращала на себя внимание значимая разница, выявленная при определении СКФ, рассчитанной различными методиками – по креатинину и цистатину С. Это согласуется с имеющимися литературными данными, поскольку уровень цистатина С по сравнению с уровнем креатинина является более надежным биохимическим индикатором нарушения фильтрационной способности почек, значимо не зависящим от расы, поло-возрастных характеристик, объема мышечной массы, физической активности и особенностей питания [19].
В группе терапии инсулином в течение 6 мес. оцениваемые показатели значимо не изменились (табл. 2). Вместе с тем в группе комбинированного лечения за 6 мес. произошло близкое к значимому повышение уровня креатинина на 2,3±5,9% (р = 0,07), что нашло отражение в значимом снижении рСКФкр, рассчитанной по формуле Кокрофта – Голта (-4,3±8,5%, р = 0,024). Однако стоит напомнить, что в этой группе произошло значимое снижение показателя массы тела (на -1,8±2,3 кг, р=0,0028), входящего в расчетную формулу, предложенную Д. Кокрофтом и Г. Голтом в 1976 г. [14]. Это подтвердил и корреляционный анализ, продемонстрировавший четкую связь динамики рСКФкр (по Кокрофту – Голту) и динамики массы тела (r=0,61, p=0,0068). К настоящему моменту убедительно продемонстрировано, что данная формула наиболее точно коррелирует с клиренсовыми методами определения СКФ только в диапазоне сниженных значений почечной функции [14, 19]. Примечательно, что изменение СКФ не зарегистрировано при использовании считающейся более точной формулы CKD-EPI рСКФцис [15]. Определение уровня цистатина С особенно целесообразно использовать при умеренно сниженных значениях СКФ (от 45 до 60 мл/мин), когда отсутствуют другие признаки поражения почек [19].
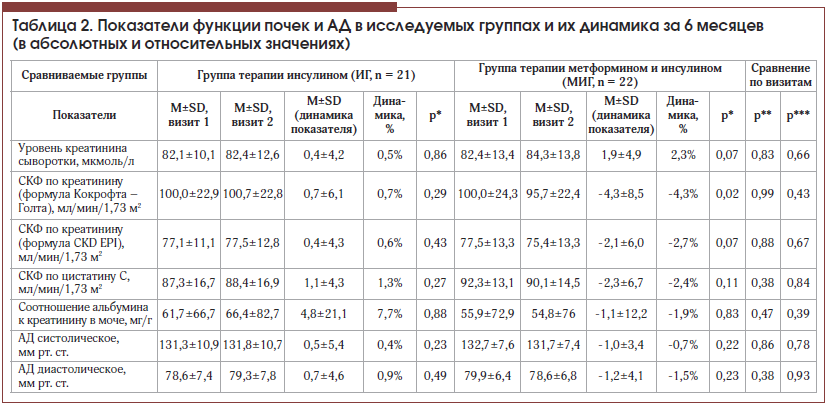
В нашем исследовании не выявлено значимого влияния добавления терапии метформином на рСКФ по цистатину С и альбумин-креатининовое соотношение. Кроме того, незначимым оказалось влияние препарата на динамику как систолического, так и диастолического АД за 6 мес. наблюдения, однако оба этих показателя снизились только в группе комбинированной терапии.
В ряде крупных исследований также оценивался эффект назначения метформина на показатели почечной функции. Так, анализ результатов 5-летнего наблюдения за пациентами с СД 2-го типа с умеренным ожирением, участвующими в исследовании ADOPT, 1454 из которых были рандомизированы получать в качестве стартовой терапии метформин в дозе 2000 мг/сут, не показал значимой способности препарата, по сравнению с терапией росиглитазоном, замедлять снижение СКФ (рассчитанной по формуле MDRD) или нарастание альбуминурии, которая на момент начала исследования выявлялась почти в 20% случаев [8]. Схожие данные получены в ходе анализа 10-летнего наблюдения пациентов, участвовавших в UKPDS: не было выявлено значимого влияния препарата на уровень креатинина и альбумин-креатининовое соотношение по сравнению с монодиетотерапией [7]. Тем не менее в этих исследованиях не наблюдалось и ухудшение почечной функции на терапии метформином. В ретроспективном анализе данных более 60 тыс. пациентов, включенных в американскую базу данных ветеранов, продемонстрировано, что терапия метформином в качестве стартового сахароснижающего препарата, по сравнению с препаратами группы сульфонилмочевины, не ассоциирована с повышенными рисками снижения СКФ и/или возникновения терминальной стадии ХПН [9]. А в небольшом по объему выборки исследовании Amador – Licona et al. даже была показана способность метформина, назначенного в субмаксимальной дозе на 12 нед. после приема глибенкламида, значимо снижать альбуминурию [20]. Исследователи связали наблюдаемый эффект с позитивным влиянием препарата на показатели углеводного обмена, метаболический статус и со снижением АД, отмеченным в группе терапии метформином.
В нашей работе также показано положительное влияние добавления метформина в отношении веса, показателей гликемии и липидограммы. Но, в отличие от вышеупомянутых исследований, препарат применяли пациенты с СД 2-го типа на инсулинотерапии, многим из которых она назначалась после длительного стажа приема пероральных сахароснижающих препаратов или на фоне возникновения острых сердечно-сосудистых событий (инфаркт миокарда, ОНМК и т. п.). В схожем по дизайну исследовании Dе Jager et al. с участием 353 пациентов с СД 2-го типа на инсулинотерапии, рандомизированных продолжать ее или получать дополнительно метформин в дозе 2550 мг/сут в течение 4 мес., исследовалось влияние препарата на маркеры эндотелиальной дисфункции и системного воспаления [21]. Обращало на себя внимание, что несмотря на снижение в группе комбинированного лечения показателей гликемии, улучшение в липидограмме и снижение потребности в инсулине, было выявлено близкое к значимому повышение альбуминурии за период наблюдения (на 21%, р = 0,06). Однако, в отличие от нашей работы, в данное исследование включались пациенты с неудовлетворительным контролем гликемии (тощаковая гликемия > 10 ммоль/л), имеющие плохо скорректированную артериальную гипертензию (АД > 160/85 мм рт. ст.) при низком проценте приема адекватной антигипертензивной терапии, что само по себе могло способствовать прогрессии альбуминурии [21]. Кроме того, в данных исследованиях не уточняется уровень гемоглобина и эритроцитов. Вместе с тем известно, что терапия метформином в субмаксимальных дозах ассоциирована с возникновением дефицита витамина В12, что может приводить к возникновению анемии [22]. Между тем в клинических исследованиях убедительно было продемонстрировано, что анемия у пациентов с диабетическим поражением почек тесно связана с дальнейшим прогрессированием почечной дисфункции [1, 23].
Выполненное исследование имеет ряд ограничений, связанных с его непродолжительностью, отсутствием перекрестного дизайна и оценки показателей расширенной липидограммы, а также с невозможностью учета влияния вида получаемого инсулина из-за немногочисленности групп пациентов. Кроме того, поскольку в ряде экспериментальных работ была показана способность метформина уменьшать повреждение эпителия почечных канальцев [24, 25], целесообразным могло бы являться включение в работу лабораторных показателей, помимо рутинных маркеров оценивающих канальцевую дисфункцию.
Выводы:
1) добавление метформина в дозе 1500 мг на 6 мес. пациентам с СД 2-го типа на инсулинотерапии без выраженной почечной дисфункции не оказывает значимого влияния на рутинные почечные маркеры и уровень АД;
2) добавление метформина к инсулинотерапии у пациентов с близкими к целевым показателями компенсации позволяет снизить потребность в инсулине при одновременном улучшении как уровня гликемии, так и других метаболических параметров.
Источник
