Гидрокортизон при язвенном колите кишечника
Микроклизмы с гидрокортизоном при язвенном колите как делать

Кишечник » Вопросы » Микроклизмы с гидрокортизоном при язвенном колите как делать
- Линейный вид
- Комбинированный вид
- Древовидный вид
Подскажите кто пользовался клизмами с гидрокортизоном, насколько эффективно? Сколько раз в сутки необходимо делать и в каком количестве? Какова длительность курса в стадии обострения? И самое главное как быть с отменой , это ведь тоже гормональный препарат и можно ли их просто прекратить делать ?(по моим данным всасывание составляет около 30-50% и длительность не должна превышать 8-ми недель если не хотите появления характерных для гормонов побочек)
я делал несколько раз в стадии обострений
эффект был классным! практически все приходило в норму! ставишь на ночь, хотя врачи говорят на полчаса, но я делал до полного всасывания на всю ночь (это еще лучше)! что удивительно — все побочные эффекты от преднизолона исчезали курс примерно 5-10 дней
однажды экспериментировал над собой — пытался уйти с преднизолона (от него у меня побочка) на гидрокортизон! увы не получилось — дело закончилось обострением
д.м.н., проф., Румянцев В.Г., зав. отделением патологии толстой кишки
ЦНИИ гастроэнтерологии Департамента здравоохранения г. Москвы
Цель терапии
Легкая и умеренная атака дистального колита
Исключается возможность индукции ремиссии дистального колита с помощью монотерапии сульфасалазином и его аналогами, хотя такие попытки еще нередко предпринимаются. Это связано с тем, что пероральные препараты не создают терапевтической концентрации в слизистой оболочке прямой и сигмовидной кишки.
5-АСК высвобождается в правых отделах толстой кишки, и лишь незначительное ее количество достигает прямой кишки. Изучение концентрации препарата в слизистой оболочке кишечника показывает, что только ректальное введение позволяет рассчитывать на эффект. Для индукции ремиссии дистального колита могут применяться как системные стероиды, так и 5-АСК.
При прочих равных условиях нужно пользоваться тем препаратом, к которому выше чувствительность больного и менять его при выявлении резистентности. Обычно эффект проявляется через 1–2 нед, но лечение активного дистального колита продолжают в течение периода, необходимого для достижения полной клинико-эндоскопической ремиссии — 6–8 нед.
При пролонгированной атаке оправдано продолжительное лечение с переходом на интермиттирующее введение препаратов 2–3 раза в неделю. Если лечение ректальными препаратами 5-АСК не приводит к желаемому результату, терапию можно усилить за счет комбинации с местными стероидами или дополнительного приема 5-АСК внутрь.
Пероральные препараты назначаются всегда при левостороннем колите и могут быть применены при более ограниченном поражении с целью предотвращения прогрессирования процесса в проксимальном направлении.
Распространенный язвенный колит легкой и средней тяжести
Лечение тяжелого язвенного колита
Применение пероральных аминосалицилатов одновременно с высокими дозами стероидов при тяжелом язвенном колите не поддерживается по следующим причинам: 1) они слабее глюкокортикоидов по противовоспалительному эффекту; 2) аминосалицилаты снижают ответ на стероиды; 3) побочные явления, возникающие на прием аминосалицилатов, могут ухудшить течение колита, а значит симулировать резистентность.
Непрерывное течение язвенного колита и гормональная зависимость
Существует категория пациентов, у которых даже в условиях адекватного лечения не удается достичь стойкого улучшения или ремиссии, нуждающихся в постоянной поддерживающей терапии. Это могут быть больные с дистальным или распространенным колитом с различной степенью активности. Среди них — больные с гормональной зависимостью.
Под гормональной зависимостью принято считать невозможность снизить дозу преднизолона ниже 10 мг/сут без обострения заболевания или вспышку процесса в течение 3 мес после прекращения гормонального лечения /7/.
В этом случае существуют четыре возможности: применение щадящего интермиттирующего приема гормонов, перевод на топические стероиды, применение азатиоприна/метотрексата или инфликсимаба.
Перевод больного на топические стероиды (будесонид) также может позволить избежать опасных побочных явлений.
Данные литературы свидетельствуют, что у 2/3 гормонально зависимых больных можно снизить или отменить системные стероиды.
Нужно помнить, что будесонид в рекомендуемой дозе (9 мг/сут) соответствует 30 мг преднизолона. Их назначают одновременно и лишь затем постепенно снижают системные стероиды до полной отмены.
Намного чаще в лечении гормонально зависимых форм воспалительных заболеваний кишечника используются иммунодепрессанты, в частности азатиоприн.
Анализ более чем 20-летнего опыта его применения при гормональнозависимом язвенном колите показал, что индукция ремиссии с одновременной отменой стероидов становится возможной у 40–80% больных. Терапию азатиоприном продолжают 4 года и более. Однако следует учитывать, что действие препарата запаздывает и появляется не ранее 3 мес.
Поэтому важно использовать адекватную дозу азатиоприна (2,0–2,5 мг/кг) и длительность (по крайней мере 6 мес). Препарат сравнительно безопасен, но у лиц с генетически низкой активностью тиопуринметилтрансферазы может наблюдаться развитие лейкопении и сепсиса. Лечение азатиоприном у них противопоказано.
К счастью, монозиготная низкая активность тиопуринметилтрансферазы встречается редко — лишь в 0,3% случаев. Еще у 11,1% отмечается гетерозиготная или промежуточная активность, требующая уменьшения дозы на 50%.
Источник: https://kishechnik-zhivot.ru/voprosy/mikroklizmy-s-gidrokortizonom-pri-yazvennom-kolite-kak-delat
Медикаментозное лечение НЯК

При этом варианте НЯК зона поражения ограничена прямой кишкой. Основой лечения является топическая терапия, которую начинают с препаратов 5 аминосалициловой кислоты (5 АСК) в виде суппозиториев (500 мг месаламина 2 раз в день) или микроклизм (2-4 грамма месаламина в 30-60 мл на ночь). Процент достижения ремиссии зависит от длительности применения препарата.
В среднем ответ можно ожидать через 2-3 недели лечения, средняя длительность лечения 3-6 недель (или до достижения клинико-эндоскопической ремиссии). При отсутствии эффекта через 6 недель лечения дальнейшее применение в качестве монотерапии, скорее всего, бесполезно.
Топическая терапия препаратами 5 АСК эффективнее чем их пероральный прием в лечении данной формы НЯК [5].
При отсутствии эффекта или непереносимости препаратов 5 АСК возникает вопрос об использовании стероидов. Необходимо помнить, что препараты аминосалициловой кислоты клинически и экономически эффективнее стероидов в терапии проктита [11], однако когда лечения ими не эффективно применение стероидов оправдано. Гидрокортизон используется в дозе 100 мг на ночь.
После введения пациент как минимум 30 минут должен находиться в положении лежа на левом боку (как и в случае применения препаратов 5 АСК в клизмах). Желательно, что бы пациент удерживал клизму, по крайней мере, в течение часа, а в идеале всю ночь. В тяжелых случаях можно применять клизмы с гидрокортизоном 2 раза в день, с последующим снижением до 1го раза.
Клинический ответ может наблюдаться уже на 3-5 день. Лечение должно быть продолжено до достижения ремиссии. При полной неэффективности терапии в течение 2-3 недель дальнейшее лечение гидрокортизоном бессмысленно. После курса лечения дольше, чем 21 день отмена препарата должна проводиться постепенно путем назначения препарата через день в течение 2-3 недель.
Лучше пациентами переносится гидрокортизон в виде пены, содержащей 90 мг препарата в виде 10 % аэрозольной пенной суспензии. Существует и гидрокортизон в виде ректальных суппозиториев содержащих 25 мг или 50 мг препарата. Они используются в дозе 75-100 мг в сутки в 2-3 приема.
Сочетание препаратов 5 АСК и стероидов более эффективно, чем каждый из них в отдельности.
Budesonide (стероид с менее выраженной системной активностью чем гидрокортизон) при сходной эффективности приводит к меньшему воздействию на уровень кортизола плазмы. Подобный эффект обеспечивается быстрой биотрасформацией в печени.
Микроклизмы содержащие этот препарат выпускаются компанией Astra Zeneca, под названием Entocort. Применение Budesonide или месаламина (4 гр.
в день) в качестве топической терапии НЯК через четыре недели лечения привело к улучшению в 67 % и 71 % случаев соответственно, причем уровень кортизола плазмы в обеих группах был одинаков [16]. Bianchi Porro G. et al.
, продемонстрировал одинаковую эффективность Entocort и гидрокортизона у пациентов с активным дистальным колитом [3]. По данным другого исследования Entocort оказался столь же эффективным и хорошо переносимым, как и месаламин, в лечении дистального колита и проктита [8].
К топическим стероидам также относятся tixocortol и beclomethasone diproprionate. Проведенный мета-анализ использования стероидов при НЯК продемонстрировал, что Budesonide имеет сходную эффективность с другими стероидными препаратами, но вызывает меньшее снижение уровня эндогенного кортизола плазмы и менее выраженные побочные эффекты. Однако он уступает препаратам 5 АСК по клинико-экономической эффективности [11].
Применение препаратов 5 АСК в сочетании со стероидами (например через день) приводит к лучшему клиническому результату, чем каждый из препаратов по отдельности [12].
При отсутствии результата от топической терапии (или при желании достижения эффекта в более короткие сроки)возникает необходимость в системном применении аминосалицилатов или стероидов, о чем мы поговорим в следующем разделе.
Дистальный и левосторонний колиты
При дистальном колите в воспалительный процесс вовлекается 30-40 см толстой кишки, если оно достигает селезеночного угла, говорят о левостороннем колите. При легкой форме дистального колита лечение сходно с таковым для проктита.
При средней и тяжелой форме, как и при левостороннем колите, чаще всего требуется не только топическая, но и системная терапия. Так сочетание системного и местного применения препаратов 5 АСК по данным одного из исследований приводило к более быстрому и полному контролю симптомов, чем каждый вид по отдельности [17].
Из препаратов этой группы используют сульфасалазин, месаламин и балсалазид (balsalazide). Проведенный мета-анализ сравнивающий плацебо сульфасалазин и другие препараты 5 АСК показал, что как сульфасалазин так и новые препараты 5 АСК превосходили плацебо по всем изучаемым показателям.
Новые препараты 5 АСК имели незначительно лучший терапевтический эффект чем сульфасалазин и лучше переносились [19]. Месаламин обычно назначается в дозе 2-4 гр. в день, которую при необходимости можно увеличить до 6 грамм. Балсалазид применяется в суточной дозе 6,75 гр. на 3 приема в течение 8-12 недель.
Существуют исследования указывающие, что этот препарат в стандартной дозе приводит к большему проценту достижения ремиссии и более быстрому (на 12-14 дней) ее наступлению по сравнению с месаламином (2,4 гр. в день), а также легче переносится пациентами [6, 15].
Преднизолон (в дозе 40-60 мг) используется у пациентов с тяжелыми формами колита или при неэффективности вышеупомянутой терапии.
Анализ терапии стероидами при НЯК показал, что их использование приводит к полной ремиссии в 54 % случаев, частичной в 30 % случаев и у 16 % пациентов они не эффективны.
Через год у 22 % больных наблюдается стероидная зависимость, а 29 % нуждается в оперативном лечении [4].
Панколит
При этой форме заболевания системная терапия играет ведущую, роль, хотя вспомогательное топическое назначение препаратов может быть полезным. При легкой форме заболевания препаратами выбора являются аминосалицилаты, при их неэффективности и тяжелой форме НЯК применяют системные стероиды.
Тяжелый/фульминантный НЯК
Согласно существующему на данный момент определению НЯК с более 6 дефекациями в день, лихорадкой, тахикардией и анемией рассматривается как тяжелый. Применение препаратов 5 АСК может привести к утяжелению колита и следовательно не рекомендуется.
В этом случае основой терапии являются внутривенные стероиды (преднизолон). Оптимальной его дозой считается 48 мг в день (по 16 мг каждые 8 часов или инфузия 2 мг в час), хотя болюсное введение также возможно. Полное парентеральное питание также показано.
При отсутствии эффекта от 7 дневной терапии встает вопрос о хирургическом лечении – колэктомии. В качестве альтернативы можно использовать цитостатики как циклоспорин в дозе 4 мг/кг/день.
В течение 7 дней лечения эффект достигается у 60-80 % пациентов [9, 10], после достижения которого пациента переводят на пероральный прием препарата (6-8 мг/кг/день) с одновременным постепенным снижением дозы стероидов.
Няк со стероидной рефрактерностью/зависимостью
В этом случае препаратами выбора являются Azathioprine (2,5 мг/кг/день) и 6-mercaptopurine (1,5 мг/кг/день). Их использование позволяет достичь ремиссии и отказаться от применения стероидов у примерно 2/3 пациентов [1,2].
Однако эффект от их применения наступает через 2-3 месяца лечения (процесс снижения дозы стероидов не должен начинаться ранее), а риск побочных эффектов высок.
Терапия этой группой препаратов также показана пациентам с возникновением рецидива НЯК при снижении дозы преднизолона ниже 15 мг в день, с рецидивом в течение 6 недель после прекращения лечения стероидами и также больным требовавших два и более курсов стероидной терапии в год.
Альтернативные методы
Существуют данные, что у курящих НЯК протекает легче и они требуют меньшего количества госпитализаций и операций по поводу данного заболевания [13].
Применение никотинового пластыря (15 мг в день) привело к большему проценту достижения ремиссии у пациентов с проктитом резистентным к топической терапии месаламином, чем добавление месаламина перорально в дозе 2 грамма в день [7].
Более того, использование содержащих никотин клизм показало себя результативным в лечении дистального колита [18].
Эффективность инфликсимаба (infliximab) у пациентов с болезнью Крона обусловило попытки его применения при НЯК. Однако данных позволяющих использовать этот препарат при НЯК пока недостаточно.
Роль антибиотиков при НЯК остается весьма дискутабельной, хотя и существуют отдельные сообщения об их успешном применение при данном заболевании.
Разные формы гепарина сравнивались с преднизолоном в лечении тяжелой формы НЯК в нескольких исследованиях. Полученные результаты противоречивы и не очень обнадеживающие.
Так работа, включавшая 25 пациентов, с тяжелым НЯК, рандомизированных на инфузию гепарина или метилпреднизолон в дозе 0,75-1,0 мг на килограмм дала следующие результаты: на 10 день терапии положительный ответ наблюдался у 69 % пациентов получавших стероиды и у 0 % получавших гепарин [14], кроме того, у 3 из 12 больных его получавших усилилось ректальное кровотечение. В то же время применение низкомолекулярного гепарина в сочетании с терапии стероидами позволило улучшить результаты лечения острого НЯК по данным одного небольшого исследования [20].
Источник: https://EndoExpert.ru/stati/medikamentoznoe-lechenie-nyak/
Источник
В статье рассмотрена роль системных и топических кортикостероидов в терапии язвенного колита
Язвенный колит (ЯК) представляет собой хроническое идиопатическое воспалительное заболевание с повреждением слизистой оболочки толстой кишки. При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением фульминантного колита) и носит диффузный характер. ЯК характеризуется периодами активного проявления симптомов заболевания, которые перемежаются периодами клинической ремиссии [1]. В 2012 г. статистический анализ показал, что в мире распространенность ЯК достигла 249 на 100 тыс. человек в Северной Америке и 505 на 100 тыс. человек в Европе; самые высокие годовые показатели заболеваемости ЯК были 19,2 на 100 тыс. человеко-лет в Северной Америке и 24,3 на 100 тыс. человеко-лет в Европе [2]. Самый высокий уровень заболеваемости, по-видимому, отмечается в возрасте 20–30 лет, хотя есть некоторые доказательства второго пика заболеваемости в более позднем возрасте [2]. Однако наличие второго пика заболеваемости признается не всеми специалистами, занимающимися воспалительными заболеваниями кишечника (ВЗК).
Эндоскопическое исследование толстой кишки у больных ЯК выявляет ряд характерных повреждений слизистой оболочки толстой кишки (СОТК): отсутствие сосудистого рисунка, гиперемию, зернистость, контактную кровоточивость, наличие эрозий и язв [1, 3]. В настоящее время заживление СОТК при ЯК рассматривается как одна из ключевых конечных точек в клинических исследованиях, а достижение заживления СОТК в клинической практике – как реальная возможность изменить течение ЯК и сохранить функции кишечника. В исследованиях последних лет показано, что заживление СО как при ЯК, так и при болезни Крона (БК) достоверно связано с большей продолжительностью клинической ремиссии заболевания, более низкой частотой рецидивов, более низким риском развития колоректального рака и более высоким качеством жизни [4, 5], а также существенно меньшей частотой кол-эктомий [6].
Существующие руководства по лечению взрослых больных ЯК в США [7], Европейском союзе [8] и Российской Федерации [9] рекомендуют в качестве первой линии терапии для индукции ремиссии у пациентов с легкой и среднетяжелой формами ЯК препараты 5-аминосалициловой кислоты (5-АСК). Такое лечение считается наиболее эффективным при комбинации системных и пероральных препаратов 5-АСК [7–9]. В случае неэффективности 5-АСК препаратами второй линии являются глюкокортикостероиды (ГКС) [7–9]. Однако ГКС I поколения, такие как преднизолон, имеют ряд побочных эффектов: повышенный риск развития инфекционных осложнений, остеопороза, синдрома Иценко – Кушинга, развитие стероидного диабета, симптоматической гипертензии и даже повышенный риск смертности по сравнению с таковым в общей популяции [7, 10–12].
В настоящее время для лечения ВЗК применяется несколько глюкокортикоидов топического действия для приема внутрь и для ректального введения: будесонид, тиксокортола пиволат, беклометазон, флютиказон [13]. В России с 2004 г. зарегистрирован и успешно применяется препарат Буденофальк (компания Dr. Falk, Германия) в форме капсул для приема внутрь. Одна капсула Буденофалька содержит 3 мг будесонида. При ряде заболеваний, например при бронхиальной астме и сезонном аллергическом рините, будесонид так же эффективен, как системные ГКС, отличаясь при этом лучшей переносимостью и меньшим влиянием на гипоталамо-гипофизарно-адреналовую систему. Это послужило основанием для применения будесонида при БК. Будесонид является первым топическим кортикостероидом, имеющим сродство к глюкокортикоидным рецепторам приблизительно в 8,5, 15 и 195 раз больше, чем у дексаметазона [14], преднизолона [15] и гидрокортизона [15] соответственно. Кроме того, будесонид почти не всасывается из кишечника, характеризуется низкой системной биодоступностью (не более 10% по сравнению с таковой преднизолона и гидрокортизона) и быстрым пресистемным метаболизмом. Последнее обеспечивает отсутствие токсичных метаболитов в крови после первого прохождения препарата через печень. Однако наиболее высокая внутрипросветная концентрация действующего вещества и, соответственно, наибольшая эффективность Буденофалька достигаются, начиная с терминального отдела подвздошной кишки и до поперечной ободочной кишки.
ЯК – это хроническое заболевание, поражающее только СОТК, сопровождающееся ее воспалением, отеком и образованием язвенных дефектов. Воспаление всегда начинается с прямой кишки, непрерывно распространяясь выше вплоть до поражения СО всех отделов толстой кишки. Таблетированный мультиматричный (ММХ) будесонид является представителем II поколения кортикостероидов, созданным для доставки активного вещества на протяжении всей толстой кишки. В фармакокинетических исследованиях среднее относительное всасывание будесонида в месте между восходящей кишкой и нисходящей/сигмовидной кишкой составило 95,9% (рис. 1) [16]. В 2-х похожих по дизайну исследованиях 3-й фазы (CORE I и II) однократный ежедневный прием будесонида ММХ 9 мг оказался эффективным и хорошо переносимым для индукции ремиссии ЯК легкой и средней степени тяжести. Частота клинической и эндоскопической ремиссии составила 17,9% (CORE I) и 17,4% (CORE II) для будесонида ММХ 9 мг по сравнению с плацебо 7,4% и 4,5% соответственно (p<0,05, будесонид ММХ 9 мг по сравнению с плацебо в обоих исследованиях), 12,1% с месалазином 2,4 г и 12,6% с будесонидом 9 мг, высвобождаемым в подвздошной кишке. По данным исследования поддерживающей терапии будесонидом в течение 12 мес., будесонид ММХ 6 мг может удлинять время до рецидива заболевания: среднее время составило 1 год для будесонида ММХ 6 мг по сравнению с 181 днем (р=0,02) для плацебо; однако необходимы дальнейшие исследования. В исследованиях CORE будесонид ММХ проявил хороший профиль безопасности; большинство нежелательных явлений (НЯ) были легкими или умеренными по своей интенсивности, серьезные НЯ были очень редкими. Более того, частота побочных реакций, возможно, связанных с глюкокортикоидами, была сравнима среди групп лечения. Долгосрочная безопасность (12 мес.) будесонида ММХ была сравнима с таковой плацебо. Эти данные подтверждают возможность включения ММХ будесонида в алгоритм лечения ЯК [17–20].
Будесонид ММХ для лечения и индукции ремиссии ЯК
Эффективность и безопасность будесонида ММХ для индукции ремиссии пациентов с легкой и умеренной активностью ЯК (индекс активности заболевания 4–10) изучались в похожих по дизайну рандомизированных исследованиях CORE I и CORE II [17–20]. В CORE I сравнивали будесонид ММХ 9 мг и 6 мг с месалазином 2,4 г и плацебо, тогда как в CORE II сравнивались те же дозы будесонида ММХ с будесонидом 9 мг, высвобождающимся в подвздошной кишке, и плацебо. В обоих исследованиях терапия проводилась 8 нед., и первичными точками были клиническая и эндоскопическая ремиссия на 8-й нед. лечения. Ремиссия определялась как индекс активности ЯК ≤ 1 со значением 0 для ректального кровотечения и частоты стула, отсутствие ранимости СО при колоноскопии, и снижение ≥ 1 эндоскопического индекса от исходного значения. В обоих исследованиях клиническая и эндоскопическая ремиссия была достигнута у значительной части пациентов, получавших будесонид ММХ 9 мг (по сравнению с плацебо). В исследовании CORE I ремиссия на 8-й нед. была достигнута у 17,9% пациентов, получавших будесонид ММХ 9 мг, у 7,4% (р=0,01) в группе плацебо и у 12,1% в группе, получавшей месалазин. В исследовании CORE II частота ремиссии к 8-й нед. составила 17,4% у пациентов, получавших будесонид ММХ 9 мг, по сравнению с 4,5% (p=0,005) и 12,6% (p=0,048) в группах, получавших плацебо и будесонид, высвобождающийся в подвздошной кишке, соответственно. Кроме этого, анализ подгруппы в исследовании CORE II показал, что при приеме будесонида ММХ 9 мг существенно большая часть пациентов с левосторонним ЯК достигла клинической и эндоскопической ремиссии, чем при приеме плацебо (17,7% по сравнению с 5,8% соответственно; p=0,03); часть пациентов с распространенным заболеванием, которые достигли клинической и эндоскопической ремиссии, также была больше при использовании будесонида ММХ 9 мг, чем при использовании плацебо (13,8% по сравнению с 0% соответственно), но это различие не было статистически значимым (p=0,10). В исследовании CORE I анализ подгрупп по тяжести заболевания показал, что у пациентов с легким течением ЯК (индекс активности ЯК 4 или 5), которые получали будесонид ММХ 9 мг или плацебо, клиническое улучшение (определялось как снижение ≥ 3 баллов индекса активности ЯК) было достигнуто у 44,4% и 25,0% пациентов соответственно; у пациентов с умеренной активностью заболевания (индекс ЯК ≥ 6 и ≤10) показатели клинического улучшения составили 39,7% и 30,1% соответственно. Более того, частота заживления СО была больше при применении будесонида MMX 9 мг, чем при применении плацебо, у пациентов с проктосигмоидитом (32,4% по сравнению с 19,5% соответственно; p=0,20) и левосторонним ЯК (40,6% по сравнению с 26,5% соответственно; p=0,22). Похожее различие в пользу будесонида ММХ 9 мг наблюдалось у пациентов с распространенным ЯК (16,1% по сравнению с 10,0% при применении плацебо), но это различие также не было статистически значимым (p=0,39). В анализе исследований CORE I и CORE II пациенты, получающие будесонид ММХ 9 мг, достигали клинической и эндоскопической ремиссии в 3 раза чаще, чем при получении плацебо [ОШ 3,3 (95% ДИ 1,7–6,4)]. Будесонид ММХ 9 мг был статистически значимо более эффективен по сравнению с плацебо у нескольких групп пациентов: мужского и женского пола ≤ 60 лет; ранее принимавших месалазин; не получавших месалазин ранее; с легким течением ЯК на исходном уровне; со средней тяжестью ЯК исходно; с проктосигмоидитом; с левосторонним ЯК; с длительностью ЯК ≥ 1 года и ≤5 лет; с длительностью ЯК > 5 лет.
Будесонид ММХ 9 мг для поддержания ремиссии ЯК
Эффективность будесонида ММХ 9 мг для поддержания ремиссии была изучена у пациентов, которые достигли клинической и эндоскопической ремиссии в исследованиях CORE I и CORE II, у пациентов в исследованиях CORE I и II, которые получали дополнительно 8 нед. лечения (будесонид ММХ 9 мг), и открытом исследовании, в котором пациенты были рандомизированы на группы, получавшие будесонид ММХ 6 мг или плацебо в течение 12 мес.; первичная точка эффективности – клиническая ремиссия, которая оценивалась через 1, 3, 6, 9 и 12 мес. Среднее время до рецидива заболевания (определялось как ректальное кровотечение, частота стула более чем 1–2 р./сут или оба этих фактора) составило 181 день в группе плацебо, но не было достигнуто в группе будесонида ММХ (p=0,02); к 12 мес. вероятность рецидива составила 59,7% и 40,9% соответственно. Однако процентное соотношение пациентов, у которых ремиссия поддерживалась в течение 12 мес., не различалось существенно между группами, что, возможно, связано со статистическими недостатками исследования.
Следовательно, польза будесонида ММХ в поддержании ремиссии в настоящее время недостаточно ясна, и необходимо проведение дальнейших исследований [21].
Побочные эффекты
В целом у молекулы будесонида более благоприятный профиль безопасности, чем у I поколения пероральных кортикостероидов, таких как преднизон или преднизолон. Например, в двойном слепом исследовании в течение 10 нед. 176 пациентов с БК, которые получали преднизолон по схеме снижения или будесонид, высвобождающийся в подвздошной кишке, в течение 10 нед., частота побочных явлений, связанных с глюкокортикоидами, была значительно ниже при применении будесонида, чем преднизолона (33% по сравнению с 55% соответственно; p=0,003). Кроме этого, подавление гипоталамо-гипофизарно-надпочечниковой системы, оцениваемое с помощью измерения средней концентрации кортизола в плазме, было существенно выше при применении преднизолона, чем будесонида, высвобождавшегося в подвздошной кишке, через 4 нед. (р<0,001) и 8 нед. (р=0,02). Благоприятный профиль НЯ будесонида ММХ у пациентов с ЯК был показан в исследованиях CORE I и II.Частота НЯ у пациентов, получающих будесонид ММХ 9 мг или 6 мг, составила 57,5% и 58,7% соответственно в исследовании CORE I, 55,5% и 62,5% соответственно – в CORE II. В обоих исследованиях большинство НЯ было легкими или умеренными по интенсивности, частота серьезных НЯ была ниже и схожей во всех группах лечения. Наиболее распространенными НЯ у пациентов, получавших будесонид ММХ, были головная боль, тошнота. В исследованиях CORE I и II частота НЯ, возможно, связанных с ГКС (акне, задержка жидкости, гиперемия, гирсутизм, инсомния, изменение настроения, «лунное» лицо, нарушение сна, образование стрий), была сравнима с таковой для будесонида ММХ 9 мг (10,2%), 6 мг (7,5 %) и плацебо (10,5%). Самыми распространенными НЯ, возможно, связанными с ГКС, при применении будесонида ММХ 9 мг по сравнению с плацебо были изменения настроения (3,5% и 4,3% соответственно) и нарушение сна (2,7% и 4,7% соответственно). В исследовании будесонида ММХ 6 мг в течение 1 года профиль безопасности был сравним с таковым плацебо [22].
Клиническое наблюдение
Больной Б., 22 года. Болен с 2013 г., диагноз «язвенный колит» поставлен при колоноскопии в ГНЦ колопроктологии и подтвержден гистологически в 2013 г. Принимал постоянно месалазин 3 г/сут. Амбулаторно проведена колоноскопия 24.11.2014 г.: язвенный колит, тотальное поражение, минимальная активность. С января 2016 г. отменил прием препаратов 5-АСК. В феврале 2016 г. отметил появление примеси крови в стуле. Возобновил прием месалазина 3 г/сут со слабоположительным эффектом, кровь в стуле сохранялась.
Однако с середины марта 2016 г. состояние ухудшилось, кроме примеси крови в стуле отмечались диарея до 17 р./сут, периодическое повышение температуры тела до 38° С в вечернее время. При колонофиброскопии от 15.03.2016 г. колоноскоп проведен в дистальный отдел восходящей части толстой кишки, заключение: эндоскопическая картина ЯК (тотальное поражение), тяжелая степень активности (рис. 2). При ЭГДС – хронический гастродуоденит с признаками выраженного обострения процесса, дуоденогастральный рефлюкс, недостаточность кардии, Нр+. Самостоятельно увеличил дозу месалазина до 4 г/сут, микроклизмы месалазина 2 г/сут на ночь со слабоположительным эффектом в виде урежения стула до 12 р./сут, примесь крови сохранялась.
![Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006) Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006)](https://www.rmj.ru/upload/medialibrary/fdc/fdce054cd022b9f2e7afc1c307ee002c.png)
18.03.2016 г. поступил на стационарное лечение в ГБУЗ МКНЦ ДЗМ. В общем анализе крови от 18.03.2016 г. отмечались лейкоцитоз (9,6 × 109) с палочкоядерным сдвигом (28%), повышение СОЭ до 26 мм/ч. В биохимическом анализе крови от 18.03.2016 г. отмечались повышение СРБ до 133,37 мг/л, латентный дефицит железа – 5,4 мкмоль/л.
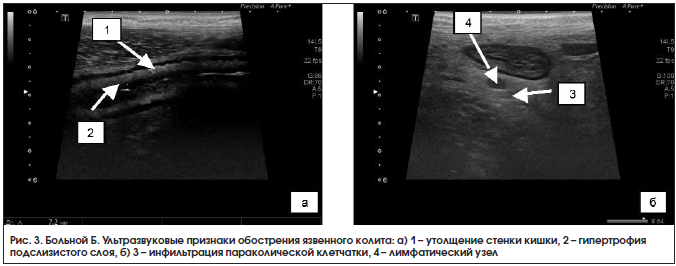
При УЗИ органов брюшной полости 18.03.2016 г.: стенка левых отделов отечная, гипоэхогенная, утолщена до 7–8 мм, гаустрация сглажена, дифференциация слоев прослеживается четко не везде, в просвете – жидкость и изоэхогенное содержимое, в толще стенки – гиперэхогенные включения, что может соответствовать наличию язвенных дефектов; по ходу нисходящего отдела и сигмовидной кишки воспалительная инфильтрация параколической клетчатки с включением л/узлов размером до 11×7 мм; свободная жидкость в правой подвздошной области в небольшом количестве; заключение: эхопризнаки язвенного колита, левостороннее поражение, воспалительная инфильтрация параколической клетчатки по ходу левых отделов ободочной кишки с лимфаденопатией, небольшое количество свободной жидкости в правой подвздошной области (рис. 3). Кальпротектин кала от 19.03.2016 г. – 840 мкг/г.

Установлен диагноз: язвенный колит, тотальное поражение, хроническое рецидивирующее течение, средней степени тяжести, умеренной активности. Латентный дефицит железа.
С учетом отсутствия у больного эффекта от терапии препаратами 5-АСК и категорического отказа от проведения терапии системными ГКС больному назначены Кортимент (топические ГКС) 9 мг/сут, месалазин 5 г/сут, микроклизмы с гидрокортизоном 125 мг 2 р./сут, метронидазол 500 мг 3 р./сут в/в, гидроксид железа 100 мг/сут № 3; цефтриаксон 2,0 г/сут в/в капельно.
На фоне терапии через 10 дней у больного отмечалось улучшение состояния в виде урежения стула до 2 р./сут, без примеси слизи и крови.
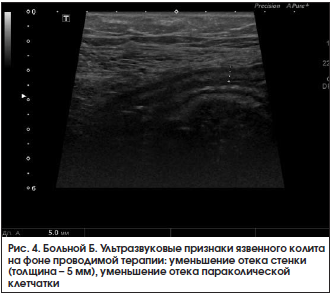
При контрольном УЗИ кишечника 28.03.2016 г.: по сравнению с предыдущим исследованием от 18.03.2016 г. отмечается положительная динамика. Тонкая кишка: петли не расширены, прослеживается ритмичная перистальтика, содержимое – средней эхогенности. Осмотрена ободочная кишка. В проекции слепой кишки, восходящего и поперечного отдела стенки не утолщены (2 мм), дифференциация слоев четкая. В проекции нисходящего отдела и сигмовидной кишки стенки толщиной 2,5–2,7 мм, слоистость стенки сохранена, более выражен подслизистый слой, в толще стенки сохраняются гиперэхогенные включения до 1,5 мм (вероятно, язвы). Клетчатка вокруг умеренно повышенной эхогенности с включением л/узлов размером до 8×3 мм. В правой подвздошной области межпетельно незначительное количество свободной жидкости. Заключение: эхопризнаки язвенного колита, левостороннее поражение, обострение. Мезентериальная лимфаденопатия (рис. 4). В общем анализе крови от 28.03.2016 г. сохраняется повышение СОЭ до 33 мм/ч. В биохимическом анализе крови от 28.03.2016 г. – нормализация уровня СРБ до 3,25 мг/л.
Заключение
Лекарственная формула будесонид ММХ доставляет лекарственное вещество в толстую кишку на всем ее протяжении [23], в то время как другие пероральные формы будесонида с контролируемым высвобождением работают только в дистальной части подвздошной кишки и в восходящей кишке – участках, которые наиболее часто поражаются воспалительным процессом при БК [24].
Будесонид ММХ является эффективным и хорошо переносится при применении с целью индукции ремиссии у пациентов с ЯК легкой и средней тяжести. Имеющиеся в настоящее время данные говорят о том, что этот препарат может быть эффективным и хорошо переноситься для поддержания длительной ремиссии (более 1 года) у пациентов с ЯК [17, 18]. Долгосрочная безопасность ММХ будесонида у пациентов с ЯК сравнима с таковой плацебо, эти данные представлены только в одном исследовании, которое длилось 12 мес. [19]. Однако в нескольких исследованиях изучали применение пероральных форм будесонида в качестве поддерживающей терапии у пациентов с БК, и это подтверждает долгосрочную (до 1 года) безопасность будесонида при поддержании ремиссии ВЗК [25–32]. Применение будесонида ММХ также может быть полезным в фармакоэкономическом плане в связи с возможным повышением приверженности терапии благодаря однократному приему препарата и снижению риска побочных явлений по сравнению с таковым при приеме традиционных пероральных кортикостероидов. Однако необходимо дальнейшее изучение этого препарата у пациентов с ВЗК.
Источник
