Биопрепараты для лечения колита
Ребенок появляется на свет со стерильным кишечником, но уже к году состав микрофлоры совпадает со взрослым человеком. На протяжении жизни под влиянием питания, болезней и других факторов баланс микроорганизмов в пищеварительном тракте изменяется, но постепенно восстанавливается до нормальных концентраций. Иногда этот процесс затягивается. Тогда врач может рекомендовать пребиотики и пробиотики для кишечника.

Виды пробиотиков
Для восстановления кишечника применяют два типа лечебных средств. Пробиотики – это препараты, которые содержат полезные бактерии в высушенном или растворенном виде. Чаще всего это микроорганизмы из рода Lactobacillus и Bifidobacterium, которые в норме доминируют в пищеварительном тракте человека.
Пребиотиками называются вещества, необходимые для роста хорошей микрофлоры. В некоторых случаях без них можно обойтись, но после тяжелых болезней, лечения антибиотиками или отравления они ускорят восстановление за счет создания благоприятной среды для бактерий.
В пищеварительном тракте здорового взрослого человека обитает несколько десятков видов бактерий, но преобладают два типа микробов: бифидобактерии и лактобактерии. Другие находятся в меньшинстве. Поэтому выделяют следующие виды пробиотиков в зависимости от состава:
- состоят только из лактобактерий – рекомендуют принимать при кишечных вирусных инфекциях;
- в составе только бифидобактерии – врачи назначают их при кандидозном поражении кишечника и как восстановление женщинам после вагинального кандидоза;
- комбинированные препараты – содержат бифидо- и лактобактерии, полезны при бактериальной инфекции кишечника.
Восстанавливать нормальную микрофлору можно разными формами препаратов. Пробиотики выпускают в сухой форме, из которой перед применением самостоятельно готовят суспензию. Существуют готовые жидкие формы лекарства, которые удобно давать маленькому ребенку. Некоторые средства производят в капсулах в желатиновой оболочке. Она не повреждается в желудке и растворяется только в кишечнике. Это защищает бактерии от действия соляной кислоты.
Создание препаратов для решения проблем с пищеварением проходило в несколько этапов. Поэтому фармацевты выделяют несколько поколений пробиотиков:
- 1 поколение – это монопрепараты, которые состоят из одного типа бактерий, обитающих в кишечнике, к ним относятся Бифидумбактерин, Лактобактерин.
- 2 поколение – содержат хорошие бактерии, которые являются антагонистами вредной флоры. Они выделяют вещества, которые уничтожают опасные микроорганизмы и подготавливают среду для заселения полезной микрофлорой. К препаратам этого типа относится Энтерол и Бактисубтил.
- 3 поколение – пробиотики, которые содержат от 2 до 30 штаммов одного живого микроорганизма или комбинацию из нескольких видов бактерий. К этой группе препаратов относятся Линекс, Бификол, Бифилонг.
- 4 поколение – содержат не только хорошие бактерии, но и вещества из группы пребиотиков. Они служат питательной средой, помогают расти, размножаться микрофлоре и ускоряют ее восстановление. К этой группе препаратов относят Бифилиз, Кипацид.
- 5 поколение – синбиотики, это несколько типов полезных бактерий и вещества, необходимые для колонизации кишечника. Они способны регулировать рост и метаболическую активность микробиоты. К этой группе относятся Флористин, Бифиформ и другие средства.
Какой препарат подойдет в конкретном случае, должен решать врач с учетом состояния пациента, его возраста. Для взрослых требуется большая дозировка и кратность приема пробиотиков.

ТОП-10 лучших пробиотиков
В аптеках продается большое количество пробиотиков, из которых тяжело выбрать нужный препарат. Правильное решение – обратиться к врачу-гастроэнтерологу или терапевту, чтобы назначили лекарственное средство с хорошим эффектом.
Чтобы решить, какой из них лучше, можно ориентироваться на список ТОП-10:
- Линекс – один из самых популярных препаратов, который помогает восстановить микрофлору кишечника. В его составе живые лиофилизированные бифидо- и лактобактерии, а также энтерококки. Линекс выпускается в капсулах и порошке, его можно применять у грудных детей, смешивая содержимое оболочки с молоком.
- Хилак Форте – капли для лечения дисбактериоза, в состав входят лактобациллы, их эффект дополняет непатогенная кишечная палочка и стрептококки. Может использоваться при синдроме раздраженного кишечника, гастроэнтерите, колите, болезнях желчного пузыря и печени, вызванных патологией пищеварительного тракта.
- Флорин Форте – восстанавливает микрофлору за счет присутствия бифидо- и лактобактерий. В состав входит лактоза, необходимая для процесса брожения, смещения рН в кишечнике в кислую сторону. Выпускается в виде саше с порошком, который необходимо растворять перед использованием.
- Нормобакт L – помогает восстанавливать кишечную флору при помощи молочнокислых бактерий и пребиотиков, необходимых для их размножения. В состав входят фруктоолигосахариды, которые являются питательной средой, увеличивают выживаемость микробиоты и увеличивают эффективность лечения.
- Аципол – средство для лечения дисбактериоза у взрослых и детей. Он помогает после длительного лечения антибиотиками терапевтических заболеваний, используется для лечения острых кишечных инфекций, хронического колита, у склонных к аллергии и атопическому дерматиту.
- Бифиформ – пробиотик, в состав которого входят энтеробактерии и бифидобактерии. В кишечнике они образуют естественный симбиоз и поддерживают существование друг друга. Энтерококк заселяет петли тонкой кишки, а используемый тип бифидобактерий обладает высокой скоростью роста, поэтому быстро восстанавливает микробиоту толстого кишечника.
- Нормофлорин Л – жидкий пробиотик, состоящий их лактобактерий. Он положительно влияет на организм благодаря добавлению в раствор пребиотика лактита, который улучшает рост бактерий. Перед использованием необходимую дозу препарата смешивают с любой жидкостью.
- Флорок – пробиотик, который состоит из лактобацилл, бифидобактерий и лактозы, необходимой для нормальной колонизации пищеварительного тракта. Может использоваться как для восстановления микрофлоры, так и для предотвращения диареи во время путешествий.
- Бак-сет Форте – это капсулы, в состав которых входит 14 видов живых полезных бактерий. Препарат рекомендован для детей старше 3 лет и взрослых для лечения нарушений стула и профилактики дисбактериоза.
- Риофлора – комплексный пробиотик, включает несколько штаммов бифидобатерий и лактобацилл, а также непатогенные стрептококки. Но в капсулах могут быть следы лактозы, молока и сои, поэтому производитель не рекомендует их использовать при повышенной чувствительности к этим веществам.

Советы по выбору
Какой из перечисленных пробиотиков поможет справиться с проблемами пищеварения, зависит от заболевания. Если организму необходима помощь после курса лечения антибиотиками, лучше использовать комплексные препараты, где добавлен пребиотик. Он ускорит заселение бактериями слизистой кишечника.
Вне зависимости от названия, для взрослых походят препараты в виде порошка, капсул или раствора. Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
При использовании средств с пробиотическими эффектами, симптомы вздутия живота, урчания, метеоризм могут усилиться из-за процесса брожения. Но это проходит самостоятельно и не требует отмены терапии. Если на фоне приема пробиотиков появилась аллергическая сыпь, лечение прекращают.
Источник
Статья посвящена оптимизации биологической терапии язвенного колита препаратом голимумаб
Язвенный колит (ЯК) – хроническое заболевание толстой кишки, характеризующееся иммунным поражением слизистой оболочки, сопровождающееся ее воспалением, отеком и образованием язвенных дефектов, проявляющееся кровавой диареей и болями в животе.
Хотя основной механизм воспаления при ЯК остается не совсем ясным, доклинические и клинические исследования продемонстрировали, что фактор некроза опухоли альфа (ФНО-α) играет ключевую роль в патогенезе ЯК, установлено, что именно неконтролируемая гиперпродукция этого цитокина лежит в основе хронизации иммунопатологического процесса [1]. Одно из наиболее ярких достижений фармакотерапии воспалительных заболеваний кишечника (ВЗК) связано с разработкой принципиально новой группы лекарственных средств – генно-инженерных биологических препаратов (ГИБП) («biologic» agents) [2]. В настоящее время к ним относят несколько полученных биотехнологическим путем препаратов: моноклональные антитела (мАТ) против определенных медиаторов, продуцируемых иммунокомпетентными клетками, или «провоспалительных» цитокинов, рекомбинантные «противовоспалительные» цитокины и естественные ингибиторы цитокинов (растворимые рецепторы, антагонисты) [2].
ГИБП, совершившие революцию в терапии ВЗК, получают все более широкое распространение в лечении больных ЯК и болезнью Крона (БК). В настоящее время в России зарегистрировано три ГИБП, являющихся анти-ФНО-α-препаратами, для лечения ЯК – инфликсимаб, голимумаб и адалимумаб. Наибольший опыт применения инфликсимаба (ИФЛ) показывает, что, несмотря на высокую эффективность препарата, у части больных ВЗК (до 20–30%) не удается достигнуть клинического улучшения (первичная неэффективность) или же у них развивается приобретенная лекарственная резистентность (вторичная неэффективность, вторичная потеря ответа). Потребность в интенсификации дозы составляет 3,9% случая на пациента в месяц при ЯК и 1,4% – при БК [3]. Вторичная потеря ответа на ИФЛ отмечается в 15% случаев при ЯК [4]. При БК ежегодный риск потери ответа составляет 13% для ИФЛ и 24% для адалимумаба (АДА) [5, 6]. Следует отметить, что на развитие вторичной потери ответа на антицитокиновую терапию влияют следующие причины: нерегулярность введения препарата, монотерапия моноклональными антителами, исходно высокий уровень ФНО-α и низкий уровень альбуминов, а также наличие антител к препарату [7].
В процессе лечения больного ЯК с использованием ИФЛ перед врачом рано или поздно могут встать вопросы: каковы причины вторичной потери ответа, каковы способы дальнейшего ведения больного при развитии вторичной потери ответа на ИФЛ?
Согласно последним исследованиям, в числе причин вторичной потери ответа могут быть активация оппортунистической инфекции [8], а также изменение патогенеза заболевания по мере его прогрессирования с уменьшением роли ФНО-α и сдвигом баланса в сторону других провоспалительных цитокинов [7]. Вероятнее всего, вторичная неэффективность анти-ФНО-α-терапии напрямую связана с потенциальной иммуногенностью ГИБП, а образовавшиеся антитела к ГИБП могут снизить эффективность биопрепаратов и/или вызвать неблагоприятные события. В многочисленных клинических исследованиях продемонстрировано, что все ГИБП обладают иммуногенностью, не зависящей от структуры молекулы ингибиторов ФНО-α [9]. Персонализированный мониторинг заболевания в целях улучшения его контроля, а также, учитывая высокую стоимость ингибиторов ФНО-α, мониторинг концентрации ИФЛ и антител к инфликсимабу позволят повысить экономический эффект от терапии ГИБП.
Путями преодоления вторичной неэффективности, в зависимости от остаточного уровня препарата в крови и наличия/отсутствия антител, являются: оптимизация терапии, включающая увеличение дозы препарата и сокращение интервалов между инфузиями; дополнительное назначение иммуносупрессоров или переход на другой анти-ФНО-α-препарат [10]. В настоящее время появилась возможность перевода больного ЯК на новый анти-ФНО-α – голимумаб (ГЛМ).
ГЛМ – полностью человеческое моноклональное антитело к ФНО-α, обладающее высокой аффинностью к ФНО-α и стабильностью молекулы, что обеспечивает его высокую эффективность и более низкую иммуногенность. Препарат обладает таким же сродством к трансмембранному ФНО-α, как и все препараты, относящиеся к данной группе, но бо’льшим сродством к растворимому ФНО-α [11]. ГЛМ одобрен для клинического использования в Евросоюзе и США в 2009 г., в России зарегистрирован в мае 2012 г.
В исследовании PURSUIT-SC больные ЯК, рефрактерные к стандартной терапии, были рандомизированы на группы, принимающие плацебо или ГЛМ, который назначался с целью индукции ремиссии в 2-х режимах: в дозе 400 мг и 200 мг или 200 мг и 100 мг. Через 6 нед. терапии доля пациентов, достигших клинической ремиссии, среди получавших ГЛМ составила 17,8%, а в группе плацебо – 6,4%. Заживление слизистой на 6-й нед. наблюдалось у 45,1 и 28,7% больных соответственно [12]. Пациенты, ответившие на индукционную терапию ГЛМ, были рандомизированы в исследуемые группы по поддержанию ремиссии и получали в течение 52 нед. ГЛМ (50 мг или 100 мг каждые 4 нед.) или плацебо. В группе больных, принимающих ГЛМ, длительность ремиссии наблюдалась в 49,7% случаев, в группе плацебо – в 31,2%, а достижение заживления слизистой – у 42,4 и 26,6% больных соответственно [12]. Высокая частота поддержания клинической ремиссии в группе плацебо (31%) объясняется особенностью дизайна исследования, согласно которому все пациенты группы плацебо получили индукцию ГЛМ и ответили на нее. Последующая отмена препарата и переход на плацебо позволили оценить безрецидивный период после проведения индукционного курса. Результаты показали, что при проведении только индукции без последующего поддерживающего курса ремиссия сохраняется в течение 6 мес. Следует также подчеркнуть уникальность дизайна этого исследования, предусматривавшего жесткий контроль эффективности ГЛМ, который включал 15 этапов промежуточной оценки (например, оценка эффективности ИФЛ в исследовании АCT1 предполагала только 2 этапа, а в исследовании ACT2 – 3 этапа). Этой особенностью объясняется не очень высокая, в сравнении с ИФЛ, частота заживления слизистой оболочки (45,1%). Анализировалась эффективность исследования, включая заживление слизистой оболочки, лишь у тех пациентов, кто продемонстрировал полный клинический ответ на всех 15 этапах оценки. Если пациент не удовлетворял критериям клинического ответа хотя бы на одном этапе оценки, то он не учитывался в финальном анализе эффективности.
Результаты этих исследований позволяют рекомендовать ГЛМ для лечения ЯК, поскольку он не только эффективен, но и удобен в применении и имеет хороший профиль безопасности [13]. До сих пор не проводились прямые исследования, сравнивающие эффективность ИФЛ и ГЛМ у больных ЯК. Преимущество ГЛМ перед ИФЛ (вводится внутривенно) заключается в облегченном режиме приема – подкожное введение, с интервалом в рамках поддерживающей терапии 4 нед. Кроме того, имеются данные о значительно более низкой иммуногенности ГЛМ. При выборе биологического препарата для лечения ЯК рекомендуется учитывать вопросы стоимости терапии, пожелания пациента относительно способа введения, а также профиль безопасности и эффективности. Пациентов, не отвечающих на предшествующую терапию, рекомендуется переводить с одного анти-ФНО-α-препарата на другой. Если применение более двух анти-ФНО-α-препаратов не позволяет достичь адекватного ответа и/или вызывает непереносимость, то рекомендуется переход на биологические препараты с другим механизмом действия [13].
АДА зарегистрирован в России для лечения ЯК только в сентябре 2015 г., поэтому отсутствуют клинический анализ применения АДА и результаты терапии ЯК в реальной клинической практике в нашей стране.
В отделе патологии кишечника МКНПЦ ДЗМ проводятся клинический анализ результатов лечения больных ЯК и БК, получающих терапию ГИБП, изучение механизмов возникновения первичной и вторичной неэффективности антицитокиновой терапии, а также поиск путей их преодоления.
Целью нашей работы являлся клинический анализ результатов лечения больных ЯК с применением ГЛМ, а также эффективности и безопасности этой терапии.
Материал и методы
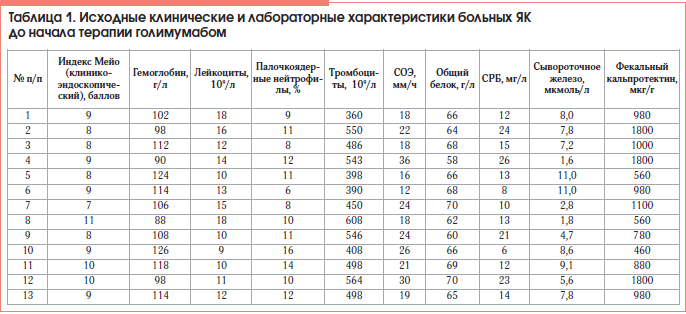
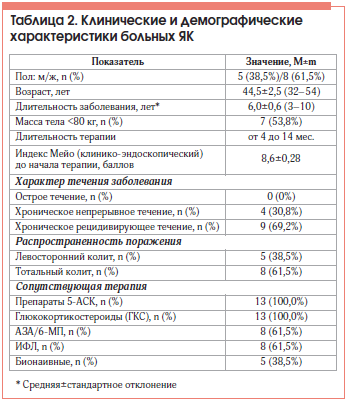
Обследовано 13 больных ЯК, получавших ГЛМ, из них 5 (38,5%) мужчин и 8 (61,5%) женщин. Средний возраст больных составил 44,5±2,5 года (от 32 до 54 лет). Большинство больных – 12 (92,3%) были со среднетяжелой степенью заболевания. Основные клинические, лабораторные и демографические характеристики пациентов представлены в таблицах 1 и 2.
Внекишечные проявления имели 10 (76,9%) больных ЯК: 6 (46,1%) – артралгии/артропатии, 1 (7,7%) – узловатую эритему, 1 (7,7%) – гангренозную пиодермию, 1 (7,7%) – анкилозирующий спондилоартрит и 1 (7,7%) – сочетание полиартропатии и узловатой эритемы.
ГЛМ вводили по схеме: индукционная доза – 200 мг п/к, затем 100 мг через 2 нед. и далее поддерживающий курс – 100 или 50 мг каждые 4 нед. в зависимости от массы тела (более или менее 80 кг соответственно). Время наблюдения за пациентами составило 52 нед. Эффективность терапии оценивали по полному индексу Мейо (клинико-эндоскопическому), СОЭ, лейкограмме, уровню гемоглобина, лейкоцитов, тромбоцитов, общего белка, СРБ, сывороточного железа, фекального кальпротектина, с интервалом 12, 26 и 56 нед.

Результаты и обсуждение
Причинами отмены ИФЛ у больных ЯК послужили возникшие осложнения. У 2 (15,4%) больных отмечались острые тяжелые инфузионные реакции на введение ИФЛ (бронхоспазм, анафилаксия) в связи с нарушением схемы введения препарата. Интервал между введениями ИФЛ составил больше 4 мес. В 1 (7,7%) случае причиной отмены ИФЛ послужила беременность, и еще в 1 (7,7%) случае отказ больной от дальнейшего введения ИФЛ объяснялся клинико-эндоскопической ремиссией. У 4 (30,7%) больных ЯК развилась вторичная потеря ответа на ИФЛ после оптимизации терапии (увеличение дозы до 10 мг/кг или уменьшение интервала введения до 4 нед.). У 1 (7,7%) больного с тяжелой степенью заболевания, которому ИФЛ был назначен как альтернатива колэктомии, впоследствии развилась вторичная потеря ответа на ИФЛ.
Течение ЯК у пациентов после начала терапии ГЛМ
После проведения индукционного курса 12 из 13 пациентов ответили на терапию и продолжили поддерживающее лечение ГЛМ по схеме. Не ответил на индукционную терапию ГЛМ 1 (7,7%) больной. Ему была выполнена плановая колэктомия в связи с прогрессирующим ухудшением состояния: продолжавшейся кровавой диареей, анемией, лейкоцитозом, повышенным уровнем СРБ, СОЭ и прокальцитонина.
Через 12 нед. у 9 (69,2%) из 12 больных, ответивших на терапию ГЛМ, достигнута клиническая ремиссия, у 3 (23,1%) – клинико-эндоскопическая ремиссия. Индекс Мейо в группе в среднем снизился с 8,6±0,28 до 1,8±0,37 балла. Динамика основных лабораторных показателей представлена в таблице 3.
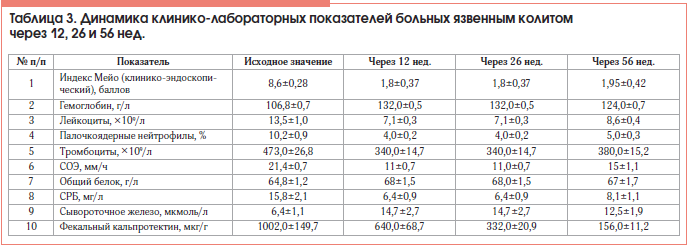
Через 26 нед. мы провели интегрированный анализ исследования индукционной и поддерживающей терапии ГЛМ больных ЯК, как бионаивных, так и получавших ГИБП ранее. Поддерживающая фаза следовала сразу за индукционной. Индекс Мейо в группе сохранялся на уровне 1,8±0,37 балла. Количество больных с заживлением слизистой оболочки кишки увеличилось до 6. Таким образом, клинико-эндоскопическая ремиссия достигнута у 50% больных ЯК, как у бионаивных, так и у получавших ранее ИФЛ. Основные клинико-лабораторные показатели в среднем оставались в пределах референсных значений (табл. 3).
Через 10 мес. от начала терапии ГЛМ у 1 больного (8,3%), достигшего клинической ремиссии ЯК, ранее получавшего ИФЛ, произошел рецидив заболевания: индекс Мейо повысился до 10 баллов, частота стула – до 8 раз в сутки, с примесью крови; гемоглобин снизился до 100 г/л; СОЭ составила 36 мм/ч; содержание лейкоцитов – 13×109/л, тромбоцитов – 555×109/л, СРБ – 21 мг/л, сывороточного железа – 8 мкмоль/л, фекального кальпротектина – >1800 мкг/г. Больному назначена терапия ГКС в рекомендуемых дозах.
Таким образом, через год от начала терапии ГЛМ клиническая ремиссия сохранялась у 5 (41,6%) больных из 12, ответивших на терапию, клинико-эндоскопическая ремиссия – у 6 (50,0%). Следует отметить, что среди бионаивных пациентов все 5 сохраняли ремиссию заболевания в течение года, в то время как рецидив ЯК и отсутствие ответа отмечались у 2 (15,4%) пациентов, ранее получавших ИФЛ. Однако сравнение частоты рецидива среди бионаивных пациентов и больных ЯК, получавших ИФЛ, не выявило статистической достоверности (р=0,45) вследствие небольшого количества наблюдений.
У 6 (60,0%) больных, ответивших на терапию ГЛМ, также отмечался регресс внекишечных проявлений: уменьшение интенсивности артралгий, регресс гангренозной пиодермии, узловатой эритемы. Однако у 2 (16,6%) больных ЯК сохранялись проявления анкилозирующего спондилоартрита и артропатии.
За год наблюдения не было отмечено ни одного случая тяжелых и нетяжелых инфекционных осложнений, обострения хронических воспалительных заболеваний.
Заключение
Появление в настоящее время в арсенале гастроэнтерологов России нового анти-ФНО-α-препарата – голимумаба – расширило возможности лечения больных ЯК в случае развития вторичной потери ответа на терапию анти-ФНО-α-препаратами или нежелательных реакций на ИФЛ. Приведенный нами анализ также продемонстрировал, что ГЛМ хорошо переносится пациентами с развившимися нежелательными явлениями на ИФЛ в виде анафилаксии. Это обусловлено тем, что ГЛМ является полностью человеческим ингибитором ФНО-α, а его низкая иммуногенность связана с особенностями строения молекулы и отсутствием необходимости направленного мутагенеза, как того требует, например, АДА [14].
ГЛМ с его отличительными свойствами открывает новые возможности в лечении больных ЯК. Многочисленные исследования подтверждают его низкую иммуногенность по сравнению с аналогичными генно-инженерными биологическими препаратами, а также отсутствие связи между наличием антител к ГЛМ и потерей клинической эффективности [10]. ГЛМ является новым, эффективным ингибитором ФНО-α, применение которого может способствовать оптимизации терапии ЯК. Применение ГЛМ при ЯК подтвердило международные данные о его эффективности в достижении клинического ответа, индукции клинической ремиссии, способности к заживлению слизистой оболочки кишки и поддержании ремиссии заболевания.
Источник
