Вирус кори рнк или днк

Вирусы у всех на слуху. С одними мы неизбежно сталкиваемся лично, например, с вирусами гриппа или теми, что вызывают простуду. Другие будоражат медицинское сообщество, наводняют новости и становятся зловещими прообразами для популярной литературы и кино.
И это неудивительно хотя бы потому, что вирусы — штука довольно непонятная. Неясно даже, считать их живыми или нет. С одной стороны, это просто хрупкий набор молекул, который не может существовать автономно, без живой клетки. Он не производит и не накапливает энергии, а также не поддерживает постоянства внутренней среды — ее попросту нет. Но когда вирус попадает в клетку, он проходит жизненный цикл, копирует себя и эволюционирует. Невидимое глазу нечто существует в огромном количестве, постоянно меняется, переходит от одних хозяев к другим и причиняет страдания разной степени тяжести всему человечеству.
Как устроены вирусы?
Вирусная частица, или вирион, — это нуклеиновая кислота (ДНК или РНК) в обертке из белков. В некоторых случаях она покрыта дополнительным слоем липидов, «украденных» у клетки-хозяина. У вирусов есть своя классификация: царства, семейства и прочие таксоны (группы), за списком которых следит Международный комитет по таксономии вирусов. Самый большой таксон — реалм. Сейчас ученые выделяют четыре реалма, из которых три — ДНК-содержащие вирусы. К ним относятся, например, вирусы оспы, герпеса и папилломавирусы.
РНК-содержащие вирусы можно разделить на собственно РНК-вирусы и ретровирусы. Первые — это вирусы гриппа, бешенства, гепатита С, а также коронавирусы и вирус Эбола. Они содержат РНК и используют для размножения РНК-зависимую РНК-полимеразу, с ее помощью на исходной молекуле РНК сразу синтезируется новая. А к ретровирусам относится, например, ВИЧ. Он содержит РНК, но в ходе жизненного цикла она превращается в ДНК и встраивается в геном клетки-хозяина. После чего новая РНК синтезируется уже на основе молекулы ДНК — то есть так же, как у нас.
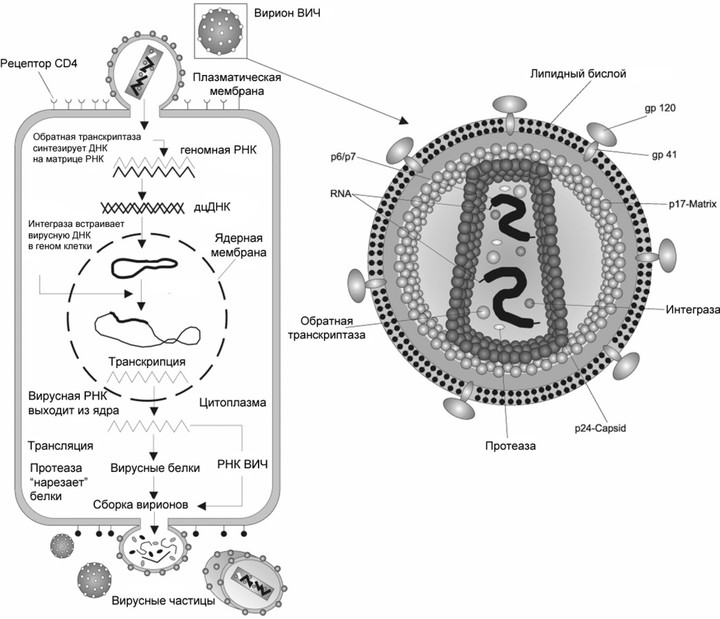 Жизненный цикл вируса, на примере вируса иммунодефицита
Жизненный цикл вируса, на примере вируса иммунодефицитаКак с ними бороться?
Можно выделить три стратегии борьбы с вирусами. Первая — «пожар проще предотвратить, чем потушить». Защититься от заражения можно по-разному, например, избегать незащищенного секса или контакта с зараженной кровью. Более изощренный способ — контроль природных резервуаров вируса: осушение болот (чтобы предотвратить вспышки желтой лихорадки), карантин, вакцинация или отстрел животных.
Еще одна стратегия — активная и пассивная иммунопрофилактика. Активная — это простая и всем знакомая вакцинация. Человеку вводят неактивную форму вируса или его кусочек, в организме срабатывает иммунный ответ и синтезируются антитела, которые защитят человека в будущем, если он когда-нибудь встретится с настоящим живым вирусом. Но вакцину не всегда можно создать, да и уже существующие порой не работают на все сто. Так, вакцина от гриппа защищает только от нескольких — самых распространенных в текущем сезоне — штаммов (видов) вируса. Пассивная иммунопрофилактика — это введение готовых антител тем, кто уже встретился с вирусом или с большой вероятностью сделает это. Такие лекарства существуют для респираторно-синцитиального вируса (рекомендованы недоношенным младенцам) и ветряной оспы (для людей с подавленным иммунитетом).
И, наконец, последняя стратегия на случай, если ничто не помогло и человек заболел, — антивирусные препараты. Их развитие подстегивали научный прогресс и насущные проблемы. Чтобы придумать противовирусный препарат, нужно сначала изучить вирус и его жизненный цикл и выбрать возможные мишени для атаки. Причем такие, чтобы они как можно сильнее отличались от человеческих аналогов. Иначе лекарство будет бороться и с вирусами, и с невинными человеческими клетками, вызывая сильные побочные эффекты.
Первые клеточные культуры, в которых можно было имитировать взаимодействие вируса с хозяином, появились в 1950-х годах. До этого удобных моделей in vitro (в пробирке) не существовало, и изучение вирусов было затруднено. Уже в 1963 году появился первый антивирусный препарат — идоксуридин. Это был нуклеозидный аналог дезоксиуридина — одного из четырех «кирпичиков» молекулы ДНК. Препарат до сих пор используется при лечении герпеса.
В 80-е произошло другое громкое открытие — вирус иммунодефицита человека. Это породило шквал научных работ, посвященных разработке новых противовирусных лекарств. К тому времени связанный с ним СПИД уже распространился по миру, а в США началась эпидемия.
Какие бывают антивирусные препараты?
Их можно разделить на 13 групп, причем к шести относятся различные лекарства против ВИЧ. Это ингибиторы входа вируса в клетку, вирусных ферментов интегразы и протеазы, а также три вида ингибиторов вирусного фермента обратной транскриптазы, или ревертазы. Все они действуют на разные этапы жизненного цикла вируса:
1. Проникновение в клетку
Это первое, что должен сделать вирус, попав в организм. То, какую клетку он поразит, определяется рецептором на ее поверхности. У ВИЧ это рецептор CD4, который есть у Т-хелперов, макрофагов, а также некоторых других видов клеток. Кроме него в связывании вируса и его проникновении участвуют: рецепторы CXCR4 и CCR5 со стороны клетки и поверхностные гликопротеины gp120 и gp41 — со стороны вируса.
Сейчас FDA (американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобряет четыре лекарства, работающие на этой стадии. Каждый связывается с каким-то из участников процесса и мешает его работе. Например, к этой группе принадлежит самый новый препарат против ВИЧ — фостемсавир, его одобрили в США в июле 2020 года. В организме он превращается в активную форму темсавир, соединяется с вирусным гликопротеином gp120 и мешает ему связаться с клеточным рецептором CD4. Другой препарат — ибализумаб — связывается с самим CD4, причем так, что рецептор не может участвовать в проникновении вируса, но выполняет свою нормальную иммунную функцию — связывает и узнает антигены на поверхности антигенпрезентирующих клеток.
Подобные препараты также используются для лечения респираторно-синцитиального вируса, вирусов ветряной оспы и простого герпеса. Они тоже действуют на вирусные гликопротеины и их связывание с клеточными рецепторами. К этой же группе можно отнести препараты для пассивной иммунопрофилактики антителами.
2. Подготовка к размножению, часть 1
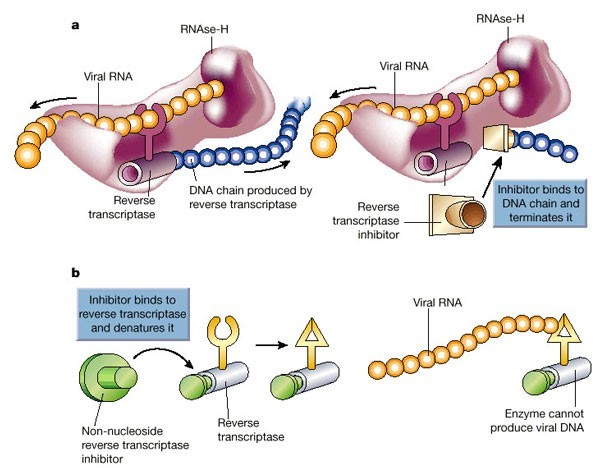
Когда вирус попал в клетку, он должен в ней размножиться, то есть создать копии себя, используя ресурсы самой клетки. Так как ВИЧ — ретровирус, его генетический материал — РНК, которая должна достроиться до двухцепочечной ДНК и встроиться в ДНК клетки. Процесс достраивания называется обратной транскрипцией, и для него необходим вирусный фермент обратная транскриптаза, ее еще называют ревертазой. Это самая популярная мишень препаратов против ВИЧ, которые делятся на две группы: нуклеозидные и ненуклеозидные.
 Механизм дейсвтия ингибиторов обратной транскриптазы
Механизм дейсвтия ингибиторов обратной транскриптазы3. Подготовка к размножению, часть 2
Чтобы наконец размножиться, ВИЧ, уже в виде молекулы ДНК, необходимо встроиться в геном клетки-хозяина. В этом участвует другой вирусный фермент — интеграза. Ее ингибируют несколько одобренных лекарств, причем они часто используются вместе с другим препаратом — кобицистатом. Он никак не действует на вирус, но ингибирует некоторые ферменты печени и увеличивает биодоступность самих антивирусных препаратов.
Попав в геном, вирус может запустить транскрипцию и синтезировать новые РНК и белки. А может и «заснуть». Именно поэтому ВИЧ почти нельзя вылечить: всегда останутся клетки со «спящим» вирусом, который себя не проявляет, а значит, не может быть мишенью для атаки. Активация вируса связана с активацией клетки. Так как ВИЧ инфицирует в основном иммунные клетки, именно те из них, что борются с инфекцией, и становятся его жертвой.
4. Созревание
Белки ВИЧ синтезируются в виде длинных полипротеинов, которые нужно «нарезать», чтобы получить зрелые формы. Для этого необходим вирусный фермент протеаза. Это — вторая по популярности мишень антивирусных препаратов. Большинство из них — белковые аналоги вирусного полипептида. Они ингибируют работу фермента, и зрелые вирусные белки и новые вирусные частицы не образуются. Подобно ингибиторам обратной транскриптазы, к препаратам из этой группы тоже очень быстро развивается резистентность. И, как и с ингибиторами вирусной интегразы, с ними часто используется кобицистат.
Препараты ингибирования вирусной протеазы также существуют для лечения вируса гепатита С. Несмотря на большие отличия в структуре и способе репликации, белки этого вируса тоже синтезируются в незрелой форме, которую нужно «нарезать».
Другие препараты
Есть три группы антивирусных препаратов, которые мы еще не упоминали. Во-первых, это ингибиторы белков NS5A и NS5B вируса гепатита С, которые играют важную роль в репликации РНК вируса. Во-вторых, лекарства против вируса гриппа: три ингибитора вирусного белка нейраминидазы и один ингибитор РНК-полимеразы вируса. И, наконец, сборная солянка препаратов, которые не действуют прицельно на вирусные компоненты. Это интерфероны, а также иммуностимуляторы и ингибиторы митоза клеток.
Первые заслуживают особого внимания из-за обилия отечественных лекарств против гриппа и простуды на их основе. FDA одобряет инъекции (!) интерферонов только для лечения гепатита B и С, причем на практике они используются очень осторожно из-за серьезных побочных эффектов. Отечественные противовирусные препараты с интерферонами, которые выпускаются в форме мазей, спреев и суппозиториев, вряд ли работают. И слава богу. Иммуностимуляторы и ингибиторы митоза клеток выпускаются в виде мазей и используются для лечения генитальных бородавок, то есть папилломавируса человека.
Наука не стоит на месте, и разработка противовирусных препаратов продолжается, подстегиваемая новыми вирусами, эпидемиями, а также развитием резистентности к существующим лекарствам. Но по-прежнему самыми изученными и многочисленными препаратами остаются ингибиторы вирусных обратной транскриптазы или ДНК-полимеразы и протеазы. Для разработки других стратегий борьбы ученым еще предстоит изучить детали работы вирусов — как давно известных, так и совершенно новых.
Да, вирусы остаются источником зловещих идей в популярной культуре. Но существующих препаратов и методов уже достаточно, чтобы мы могли избежать заражения, быстро вылечиться или свести негативные последствия болезни к нулю.
Источник

Почему одни вирусы остаются локальными, а другие — становятся причиной пандемии? Можно ли предсказать пандемию? Когда мы получим вакцину и лекарство — и как они будут работать? Корреспондент «СПИД.ЦЕНТРа» Ника Воюцкая узнала ответы на эти вопросы у петербургского вирусолога и исполняющего обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого Андрея Васина.
— Давайте повторим для читателя еще раз, что вообще из себя представляет новый коронавирус?
— Новый коронавирус — SARS-Cov-2 — представитель одного из многочисленных семейств РНК-содержащих вирусов человека и животных. Вирус — это упакованная молекула нуклеиновой кислоты (ДНК или РНК). Для размножения вирус должен попасть в клетки хозяина, а он, в свою очередь, сопротивляется и вырабатывает механизм защиты, который вирус пытается обойти.
— Причем вирусы эволюционируют быстрее, чем клеточные организмы…
— Да. В этом их преимущество. Организм хозяина (например, человека) так быстро эволюционировать не может, потому что устроен сложнее. Каждый раз, когда появляется новый вирус или новая разновидность уже известного вируса, организму нужно время, чтобы выработать защиту.
Вирус заразил клетку — клетка выработала защиту против вируса — вирус накопил определенное количество ошибок в геноме, и какие-то из них позволили вирусу обойти защиту клетки — вирус размножается дальше. Эволюция, с точки зрения вирусологии, — это история войны клеточных организмов с вирусами, в результате которой и те и другие меняются и приспосабливаются друг к другу.
 Андрей Васин, вирусолог, исполняющий обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого, Санкт-Петербург.
Андрей Васин, вирусолог, исполняющий обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого, Санкт-Петербург.— Если вирусы такие классные, почему мы, люди, до сих пор живы?
— Вирусу выгодно инфицировать клетку, но не убивать ее. Где он будет дальше размножаться? 1918 год. «Испанка», новый вирус, к которому не было популяционного иммунитета. 50 млн человек умерли за один эпидемический сезон. Кто-то выжил — и приобрел иммунитет к «испанке». На следующий год заболевание у переболевших прошло в гораздо более легкой форме — потому что появился иммунитет к вирусу. Резюме: когда новый вирус попадает в популяцию, смертность от него высокая (но для разных вирусов разная: может быть 1–2 %, может — 50 %). Проходит время, вирус и организм адаптируются друг к другу, что приводит к снижению тяжести заболевания и летальности.
— Спрошу сразу: когда нам ожидать лекарство от нового коронавируса?
— Разрабатывать новое лекарство очень сложно и долго. Если не говорить о препаратах, созданных методами генной инженерии, а о традиционных низкомолекулярных лекарствах — на это может уйти около десяти лет и несколько миллиардов долларов.
Поэтому вместо изобретения нового лекарства от COVID-19 исследователи делают repurposing of the drugs — испытывают против нового коронавируса уже известные препараты. На первых этапах проводят скрининг с помощью биоинформатики и компьютерного моделирования. Дальше — экспериментальная проверка.
Так можно пропустить целый этап проверки безопасности и токсичности. Ученым остается лишь доказать, что препарат эффективен при этом заболевании и именно при этом заболевании не вызовет побочных эффектов.

Сейчас испытывается множество таких лекарств — четыре наиболее перспективных выбрала ВОЗ, но, вообще, их гораздо больше. Китай испытывает все подряд, от новейших разработок до традиционной китайской медицины, — вдруг сработает? У них есть такая возможность.
— А как вообще лекарство от одного вируса может победить другой вирус?
— Возьмем «Калетру» (Лопинавир + Ритонавир) — ингибитор протеазы ВИЧ — и один из препаратов, исследуемых сейчас ВОЗ для лечения коронавируса. Идея вот в чем: у коронавируса тоже есть фермент протеаза. Вдруг ингибитор протеазы ВИЧ проингибирует и протеазу нового вируса? То же касается и ингибиторов полимеразы (Ремдезивир, Фавипиравир) — фермента, который позволяет вирусам реплицировать свой геном.
— «Калетра» в китайском рандомизированном контролируемом исследовании показала себя неэффективной. Пациентов было 199. Это окончательный результат?
— Пациенты — неоднородная масса людей, и у всех заболевание протекает по-разному. Опасность исследования с маленькой выборкой в том, что в него теоретически могли попасть именно те люди, для которых препарат оказался малоэффективным. Или наоборот. А большая выборка может показать, что для другой группы пациентов препарат сработает. Поэтому нужно больше исследований.
— Как работает Ремдезивир — еще одно потенциальное лекарство от коронавируса? Читаю, что это ингибитор РНК-зависимой РНК-полимеразы, но не понимаю, что это значит.
— Цепочка РНК вируса состоит из нуклеотидов: A, C, U и G. РНК-полимераза — вирусный фермент, который эту цепочку распознает и копирует. Если мы добавляем модифицированное основание, оно распознается полимеразой и автоматически добавляется к цепочке как обычный нуклеотид. Но новый нуклеотид к этой цепочке присоединиться уже не может. Или свойства этой цепочки нарушаются. Так мы блокируем РНК-полимеразу, и вирус больше не реплицируется.
— Пока самые обнадеживающие новости — о Хлорохине и Гидроксихлорохине. Французские ученые успешно провели клиническое исследование Гидроксихлорохина в лечении COVID-19. Можно говорить о победе?
— Это дает надежду, но выводы делать рано. Нужны исследования с большей выборкой. Разница между эффективностью плацебо и препарата оказалась достоверной, но в исследовании участвовали всего 36 человек. Эти препараты успешно лечат малярию, но как они себя поведут и какие побочные действия дадут при лечении коронавируса — пока неизвестно.
— Есть еще терапия антителами. Как она работает и когда ее ждать?
— Что такое антитело? Это молекула, которая вырабатывается клетками иммунной системы и нейтрализует вирус. Можно сделать его искусственно и ввести человеку, остановив тем самым распространение вируса. Подход старый: на заре вирусологии брали кровь переболевшего человека и вводили больному — иногда помогало, но давало много побочных эффектов. Сейчас антитела находят, выделяют, очищают и делают из них препарат.
Антитело, которые мы получаем в лаборатории, может эффективно нейтрализовать вирус. Но это большая белковая молекула, и она может быть токсичной, дать серьезные побочные эффекты или просто потерять активность. Можно не синтезировать антитело в лаборатории, а сделать так, чтобы сам организм его синтезировал.
Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Но можно предположить, что пожизненного иммунитета к нему не будет.
Для этого определяем генетическую последовательность, кодирующую антитело, и «записываем» ее в молекулу мРНК. Эту молекулу вводим в организм. Там уже внутри клетки происходит трансляция молекулы мРНК, и антитело синтезируется в «естественных» условиях.
То есть мы делаем молекулу «кода», вводим в организм — и организм расшифровывает «код» и сам производит антитела. Молекулы РНК меньше размером, чем молекулы белка, стабильнее, гомогеннее по структуре и проще в производстве, чем молекулы антитела, — в этом их преимущество.
До конца пандемии разработать эффективную антительную терапию от COVID-19, а тем более на основе мРНК точно не получится. Но есть надежда, что пандемия SARS-CoV-2 ускорит развитие противовирусных иммунобиотехнологий и произойдет технологический рывок. И это позволит человечеству подойти к новой пандемии более подготовленным, чем к пандемии SARS-CoV-2.
—Насколько, вообще, часто появляются новые вирусы?
— Глобальные, как SARS-CoV-2, — не так уж часто. Ближайшая к нам сходная пандемия — та самая «испанка» 1918 года. Новый коронавирус — вторая крупная пандемия современного мира, потенциально сравнимая с «испанкой» по масштабу и скорости распространения (но не по смертности). Есть пандемия ВИЧ — но она растянута во времени. Была пандемия свиного гриппа 2009 года, но не столь опасная: вызвана новым вариантом вируса гриппа, но все же гриппом, против которого уже были препараты и технологии производства вакцин.
— Почему одни вирусы остаются локальными, а другие вызывают пандемию? Коронавирусы SARS или MERS не привели к пандемии. А ведь это относительно недалекое прошлое, когда было и авиасообщение, и высокая плотность населения в городах.
— Дело, скорее, в биологических свойствах конкретного вируса, а не в свойствах популяции. Чтобы вирус широко распространился, у него должно одновременно совпасть несколько характеристик: специфичность к рецептору на клетке, распространенность этого рецептора, эффективность репликации в данном типе клеток и многое другое.
При этом быстро распространиться могут только те вирусы, которые передаются воздушно-капельным и контактным путем. Вирус Эбола передавался с инфицированными биологическими жидкостями — поэтому его получилось локализовать. SARS и MERS также не обладали набором свойств для быстрого глобального распространения. А в новом коронавирусе «удачные» для распространения свойства совпали.
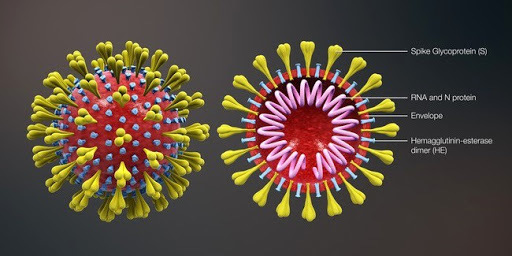 Строение коронавируса COVID-19, модель.
Строение коронавируса COVID-19, модель. — Можно ли предсказать пандемию?
— Какой из вирусов станет пандемическим и как он будет распространяться — нет, это процесс стохастический. Вирус быстро накапливает мутации, происходит изменение его характеристик и свойств. Это абсолютно случайный процесс, хотя и подверженный действию отбора. При этом было известно, что коронавирусы обладают пандемическим потенциалом, можно было ожидать, что один из них приведет к пандемии. Но невозможно было предсказать, когда это случится.
— Как определить, что вирус обладает пандемическим потенциалом?
— Новые вирусы человека не возникают ниоткуда — это зоонозный тип передачи: от летучих мышей, обезьян и кого угодно из животных, с кем у человека есть контакт. Если изучать вирусы, которые циркулируют среди животных, можно предположить, какие из них потенциально могут преодолеть межвидовой барьер и «перепрыгнуть» на человека. А они могут, если животное эволюционно близкое человеку (обезьяны) или у него есть общие гомологичные рецепторы (летучие мыши — панголины — человек).
Возьмем птичий грипп: высокопатогенный вирус гриппа птиц H5N1 преодолел межвидовой барьер. Но, к счастью, от человека к человеку не передавался. Вот если бы он мутировал так, что смог бы передаваться от человека к человеку, мы получили бы пандемию с очень высокой степенью летальности. Поэтому изучению гриппа птиц уделяют много внимания.
Так что есть постоянная угроза пандемии. Мы не можем предсказать ни время начала, ни источник, ни летальность. Это как с землетрясениями: может быть? Да. Повлиять или предсказать можем? Нет. Пандемия с высокой летальностью может случиться раз в сто лет, а может — раз в шестьсот. Или, может, через год будет новая.
— Будет ли иммунитет у тех, кто переболел новым коронавирусом?
— Коронавирусы человека не очень хорошо изучены: среди людей до настоящего времени встречались всего шесть представителей семейства. Четыре (OC43, HKU1, NL63 и 229E) вызывают обычные легкие респираторные инфекции и не были особо интересны исследователям. Еще два, SARS и MERS — вирусы атипичной пневмонии и ближневосточного респираторного синдрома, — изучались, но инфекции были ограниченными. Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Можно предположить, что раз этот вирус РНК-содержащий, то он является вариабельным, то есть быстро изменяющимся, — и пожизненного иммунитета к нему не будет. Скорее, длительность иммунитета будет как к гриппу, относительно короткой.
— Что будет, если те, кто переболел и выздоровел, заболеют снова? Статистика смертности от нового коронавируса значительно выше, чем от гриппа.
— Есть вероятность, что новый коронавирус станет сезонным и будет, как грипп, циркулировать и создавать ежегодные эпидемические вспышки. При этом чем дольше вирус будет циркулировать в популяции, чем больше людей переболеют им в первый раз, тем легче он будет переноситься. И тем ниже будет вероятность осложнений и смерти в результате заражения. Тогда уже можно будет сравнивать смертность от сезонного гриппа и сезонного коронавируса SARS-CoV-2.
Разработать вакцину быстро невозможно. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
«Пра-пра-прадедушкой» всех современных вирусов гриппа можно считать тот самый вирус «испанки» 1918 года. Со временем в результате мутаций и замен некоторых генов из него образовались циркулирующие в настоящее время вирусы гриппа А. Сначала «испанка» унесла жизни 50 млн человек, сейчас же смертность от гриппа относительно невысокая. Вирус «привык» к людям, иммунная система людей «привыкла» к вирусу. (Не стоит забывать и о вакцинации против гриппа!) Наше идеальное сосуществование с новым вирусом будет тогда, когда летальных случаев не будет, а еще лучше — не будет тяжелых случаев.
— Как быстро появится вакцина от SARS-CoV-2?
— Разработать вакцину быстро невозможно. Сейчас часто пишут, что с современными технологиями сделать новую вакцину можно быстро. Это не так. Что такое «разработать»? Сделать в лаборатории некую биологическую конструкцию, которая потенциально может защищать организм, — требует месяца-двух.
Но то, что создано in silico и получено в лаборатории, нужно испытать на животных. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
 Антитела (или иммуноглобулины) — это особые белковые молекулы, вырабатываемые иммуной системой организма, для того, чтобы бороться с вирусами.
Антитела (или иммуноглобулины) — это особые белковые молекулы, вырабатываемые иммуной системой организма, для того, чтобы бороться с вирусами. На этом этапе вакцину испытывают по двум направлениям. Первое — безопасность. Второе — насколько она защищает от вируса. Для этого нужно использовать релевантную животную модель вирусной инфекции — то есть сначала адаптировать новый вирус к организму подопытного животного. Иногда адаптировать вирус получается быстро и легко, иногда нет. При этом развитие инфекции в животном должно имитировать человеческое. Если вирус респираторный — то и у лабораторного животного болезнь должна поражать органы дыхания.
— Как разрабатывается сама вакцина, ее формула? Тот самый первый этап, который теперь можно сделать за месяц.
— Можно ослабить или инактивировать вирус — это традиционный подход, но сейчас мало кто так делает — все делают генно-инженерные вакцины (векторные, рекомбинантные, ДНК, РНК). Для этого нужна только последовательность генома вируса. Имея ее, мы понимаем, какие белки этот геном кодирует, что вот этот белок, например, — поверхностный, и на него должны образовываться антитела, и т.д. Берем фрагмент гена/ген целиком/несколько генов вируса, синтезируем и вставляем в генетическую конструкцию. Она будет кодировать вакцинный антиген и/или саму вакцину. Дальше — испытываем на животных.
— Хорошо, мы создали вакцину в пробирке. Потом адаптировали вирус под животное, ввели ему вакцину, заразили, вакцина подействовала. Это заняло 7 месяцев. Что дальше? Уже можно вакцинировать людей?
— Пока нет. Следующая стадия — проверка безопасности на людях: находим здоровых добровольцев и вводим им вакцину. Если побочных реакций нет, испытываем вакцину на людях, которые могут заразиться этим вирусом. Стадия клинических исследований может длиться год, два, три… Но и это не все.
Если клинические исследования прошли успешно, нужно зарегистрировать вакцину и привить, скажем, 40 млн человек. Для этого нужно произвести 40 миллионов доз. Что может оказаться даже более сложной задачей, чем разработка самой вакцины. И только когда мы прошли путь от идеи до миллионов привитых, можно сказать: «Мы создали вакцину». В случае пандемии, когда все что можно упрощается и есть готовые производственные мощности, этот путь может занять полтора-два года. И это самый оптимистичный прогноз.
по теме

Общество
Пострадавшие от карантина: адвокат о перегибах во время пандемии
— Как насчет пессимистичного?
— Может оказаться, что вы создали и произвели вакцину, зарегистрировали ее, привили людей — и тут обнаружили, что вакцина малоэффективна или дает побочные эффекты, которые не обнаружились в клинических исследованиях. Такая история была с вакциной от лихорадки Денге. При вакцинации ею возник феномен antibody-dependent enhancement — антитело-зависимого усиления инфекции. Вот как он выглядит. Вы ввели вакцину, и в организме образовались антитела, которые должны вас защищать. Но при заражении таким же или родственным вирусом антитела парадоксальным образом усиливают инфекцию. Для коронавирусов такой эффект описан, и разработчики вакцины против SARS-CoV-2 держат в уме этот феномен.
— Лаборатории по всему миру работают над вакциной и лекарством от коронавируса. Не эффективнее собрать рабочую группу из самых умных и талантливых, чтобы они работали вместе?
— Здоровую конкуренцию никто не отменял, а если собрать разных специалистов в одну лабораторию, все перессорятся, отстаивая свою точку зрения. (Смеется.) А если серьезно, то у каждой лаборатории есть своя специализация и свои технологии. Раньше был подход: «Одна болезнь — одна вакцина», и для каждой инфекции была своя технология получения вакцины. Но инфекций много, и разрабатывать под каждую что-то уникальное дорого, долго и просто невыгодно. Поэтому появляются платформенные технологии разработки и производства вакцин: есть некая универсальная платформа, и мы меняет в ней один вариабельный компонент под конкретную вакцину. При этом производственная цепочка остается неизменной. У кого именно получится создать вакцину? Получится создать ее на такой платформе или, наоборот, с использованием более традиционных подходов? Я не знаю. Никто не знает.
Источник
