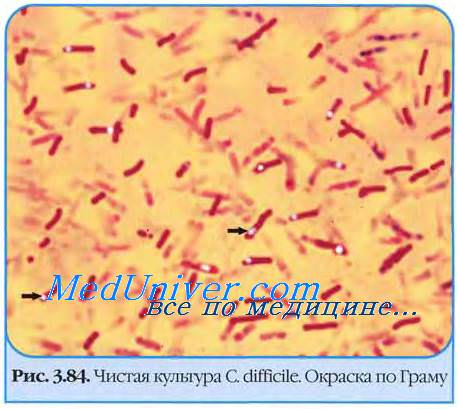
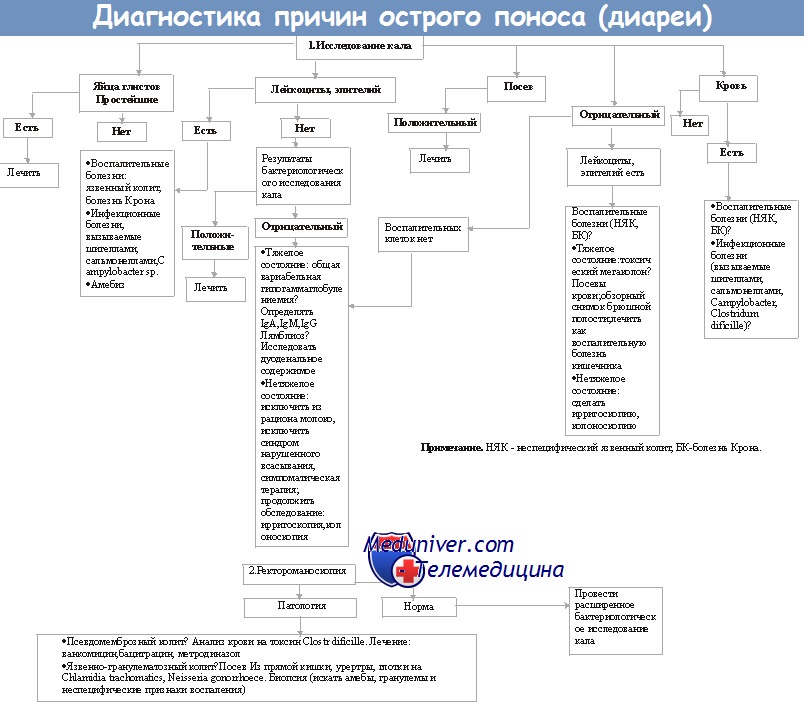
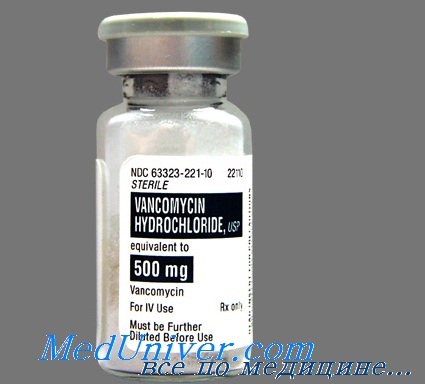
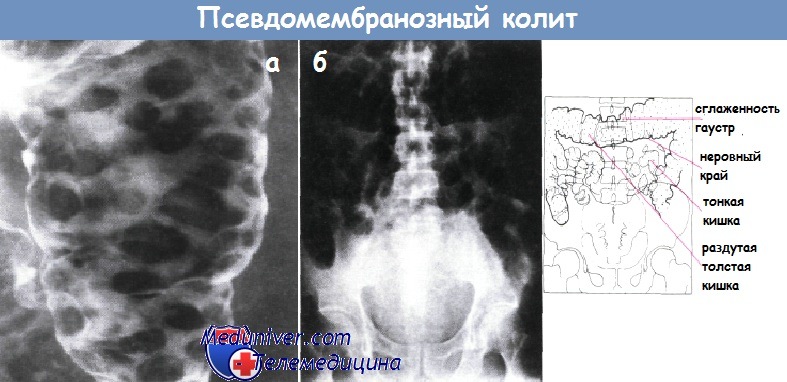
Псевдомембранозный колит методические рекомендации
Полный текст статьи:
Этиология и патогенез
Основная причина псевдомембранозного колита — это активность Clostridium difficile. Данный патогенетический микроорганизм является спорообразующим анаэробом. Однако несмотря на то, что ещё в 1978 была установлена связь между этим микробом и заболеванием, клостридия далеко не всегда приводит к патологическим изменениям, а тяжесть течения и прогрессирование заболевания могут изменяться в зависимости от индивидуальных особенностей организма.
Патогенез данной болезни включает в себя несколько стадий:
- Нарушение нормального состава микробиоты кишечника.
- Колонизация штаммов Clostridium difficile.
- Выработка бактерией токсинов.
- Начало местного воспалительного процесса и поражение слизистой оболочки.
Симптомы
Главным признаком классического псевдомембранозного колита служит диарея. Стул больного становится водянистым, частым, не содержит кровь и выделяется малыми порциями. Также наблюдается приступообразная боль в животе, общая слабость, тошнота и беспричинная потеря веса. При прогрессировании патологии происходит присоединение системных поражений, которые проявляются следующим образом:
- Спутанность сознания.
- Лихорадка до высоких цифр.
- Тахикардия больше 100 ударов в минуту.
- Низкое артериальное давление.
- Расстройство дыхательной функции.
- Чрезмерно высокие показатели лейкоцитов крови.
- Перфорация толстой кишки.
- Перитонит и летальный исход.
Клинические рекомендации ВОЗ считают “Золотым стандартом” диагностирования псевдомембранозного колита выявление токсинов Clostridium difficile в каловых массах больного. В лабораторных условиях определяют наличие как токсина А, так и В. Этой находки достаточно для подтверждения диагноза и начала эффективной терапии. Помимо этого, возможно назначение рентгенографии кишечника с дополнительным контрастированием.
На рентген-снимке удается определить степень поражения кишечной стенки, что особенно важно при решении вопроса о назначении хирургического вмешательства. При отсутствии достаточных диагностических данных возможно проведение эндоскопического обследования, во время которого в режиме реального времени оценивается состояние кишечника.
Как лечить?
Псевдомембранозный колит, лечение которого отличается высокой эффективностью, нуждается в длительной и беспрерывной терапии. Важнейшей составляющей успешного выздоровления является отмена антибиотика (если выявлена связь между его приемом и развитием патологии). При легкой степени заболевания этого может быть достаточно.
Если болезнь протекает в более тяжёлой форме, то больному назначается прием препаратов, направленный на подавление активности Clostridium difficile (Метронидазол, Ванкомицин и т.п.). В среднем, длительность терапии составляет от 10 до 14 суток. Классическая схема терапии псевдомембранозного колита выглядит так:
- Отмена антибактериальных препаратов.
- Отмена всех антиперистальтических лекарственных средств.
- Смета (в стандартной дозе).
- Линукс или Хилак-Форте.
- Метронидазол или Ванкомицин.
- Устранение нарушений водно-электролитного баланса (то есть, симптоматическое лечение, подбираемое каждому пациенту отдельно).
Отсутствие желаемого эффекта от консервативного лечения приводит к необходимости оперативного вмешательства. Чаще всего это происходит при перитоните и токсической дилатации кишки с повышенным риском перфорации. Хирурги отдают предпочтение субтотальной колэктомии. Её суть заключается в полном удалении пораженного участка кишки. Недостатком этой операции служит высокий риск смертности, достигающий 58%.
Источник
1. Рациональная фармакотерапия заболеваний органов пищеварения / Под ред. В.Т. Ивашкина. М.: Литтерра, 2011; 522-6
2. Корнеева О.Н., Ивашкин В.Т. Антибиотикоассоциированный колит: патоморфология, клиника, лечение. Рос журн гастроэнтерол гепатол колопроктол 2007; 17(3):65-70
3. Goudarzi M., Seyedjavadi S.S., Goudarzi H., Mehdizadeh Aghdam E., Nazeri S. Clostridium difficile infection: Epidemiology, pathogenesis, risk factors, and therapeutic options. Scientifica 2014; 2014:916826.
4. Culligan E.P., Sleator R.D. Advances in the microbiome: Applications to Clostridium difficile infection. Article ID 916826. J Clin Med 2016; 5(9).
5. Ивашкин В.Т., Шифрин О.С., Тертычный А.С., Полуэктова Е.А., Лапина Т.Л., Ляшенко О.С., Ивашкин К.В. Clostridium difficile-ассоциированная болезнь Рос журн гастроэнтерол гепатол колопроктол 2015; 25(6):5-17.
6. Шептулин А.А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile. Рос журн гастроэнтерол гепатол колопроктол 2011; 21(2):50-3
7. Lessa F.C., Gould C.V., McDonald L.C. Current status of Clostridium difficile infection epidemiology. Clin Infect Dis 2012; 55:65-70.
8. DePestel D., Aronoff D.M. Epidemiology of Clostridium difficile infection. J Pharm Pract 2013; 26(5):464-75.
9. Redelings M.D., Sorvillo F., Mascola L. Increase in Clostridium difficile-related mortality rates, United States 1999-2004. Emerg Infect Dis 2007; 13:1417-9.
10. Lessa F.C., Mu Y., Bamberg W.M., Beldavs Z.G., Dumyati G.K., Dunn J.R., Farley M.M., Holzbauer S.M., Meek J.I., Phipps E.C., et al. Burden of Clostridium difficile infection in the united states. N Engl J Med 2015; 372:825-34.
11. Davies K.A., Longshaw C.M., Davis G.L., Bouza E., et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, pointprevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014; 14(12):1208-19.
12. Gupta A., Khanna S. Community-acquired Clostridium difficile infection: an increasing public health threat. Infect Drug Resist 2014; 7:63-72.
13. Захарова Н.В., Филь Т.С. Микробиологические и клинические особенности инфекции Clostridium difficile. Инфекционные болезни 2015; 13(3):81-6.
14. Furuya-Kanamori L., Marquess J., Yakob L., et al. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications BMC Infect Dis 2015; 15:516.
15. Surawicz С.M., Brandt L.J., Binion D.G., Ananthakrishnan A.N., Curry S.R., Gilligan P.H., McFarland L.V., Mellow M., Zuckerbraun B.S. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections Am J Gastroenterol 2013; 108(4):478-98.
16. Paredes-Sabja D., Shen A., Sorg J.A. Clostridium difficile spore biology: sporulation, germination, and spore structural proteins. Trends Microbiol 2014; 22:406-416.
17. Britton R.A., Young V.B. Role of the intestinal microbiota in resistance to colonization by Clostridium difficile. Gastroenterology 2014; 146:1547-53.
18. Sarker M.R., Paredes-Sabja D. Molecular basis of early stages of Clostridium difficile infection: germination and colonization. Future Microbiol 2002; 7:933-43.
19. Sun X., Savidge T., Feng H. The enterotoxicity of Clostridium difficile toxins. Toxins (Basel) 2010; 2(7):1848-80.
20. Warny M., Pepin J., Fang A., Killgore G., Thompson A., Brazier J., Frost E., McDonald L.C. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366(9491):1079-84.
21. McDonald L.C., Killgore G.E., Thompson A., Owens R.C.Jr., Kazakova S.V., Sambol S.P., Johnson S., Gerding D.N. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med 2005; 353(23):243341.
22. Geric B., Rupnik M., Gerding D.N., Grabnar M., Johnson S. Distribution of Clostridium difficile variant toxinotypes and strains with binary toxin genes among clinical isolates in an American hospital. J Med Microbiol 2004; 53(Pt 9):887-94.
23. Sartelli M., Malangoni M.A., Abu-Zidan F.M., Griffiths E.A., di Bella S., et al. WSES guidelines for management of Clostridium difficile infection in surgical patients World J Emerg Surg 2015; 10:38.
24. McDonald L.C., et al. Centers for disease control and prevention. Vital signs: preventing Clostridium difficile infections. Morb Mortal Wkly Rep 2012; 61(9):157-62 https://www.cdc.gov/mmwr
25. Hensgens M.P., Goorhuis A., Dekkers O.M., Kuijper E.J. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67:742-8.
26. Spigaglia P. Recent advances in the understanding of antibiotic resistance in Clostridium difficile infection Ther Adv Infect Dis 2016; 3(1):23-42.
27. Keller J.M., Surawicz C.M. Clostridium difficile infection in eldery. Clin Geriatr Med 2014; 30:79-93.
28. Vecchio A.L., Zacur G.M. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012; 28:1-9.
29. Furuya-Kanamori L., Stone J.C., Clark J., McKenzie S.J., Yakob L., Paterson D.L., et al. Comorbidities, exposure to medications, and the risk of community-acquired Clostridium difficile infection: A systematic review and meta-analysis. Infect Control Hosp Epidemiol 2015; 36(2):132-41.
30. Haines C.F., Moore R.D., Bartlett J.G., Sears C.L., Cosgrove S.E., Carroll K., et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes. AIDS2013; 27(17):2799-807.
31. Rodemann J.F., Dubberke E.R., Reske K.A., et al. Incidence of Clostridium difficile infection in inflammatory bowel disease. Clin Gastroenterol Hepatol 2007; 5:339-44.
32. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхак Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Лапина Т.Л., Маев И.В., Москалев А.И., Низов А.И., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е.А., Румянцев В.Г., Тимербулатов В.М., Тертычный А.С., Ткачев А.В., Трухманов А.С., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных язвенным колитом. Рос журн гастроэнтерол гепатол колопроктол 2015; 25(1):48-65.
33. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхаков Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Низов А.А., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е.А., Румянцев В.Г., Тимербулатов В.М., Ткачев А.В., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых пациентов с болезнью Крона. https://www.gastro.ru/
34. Thibault R., Graf S., Clerc A., Delieuvin N., Heidegger C.P., Pichard C. Diarrhoea in the ICU: respective contribution of feeding and antibiotics. Crit Care 2013; 17(4):153.
35. Bavishi C., DuPont H.L. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011; 34:1269-81.
36. Deshpande A., Pant C., Pasupuleti V., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis. Clin Gastroenterol Hepatol 2012; 10:225-33.
37. Stevens V., Dumyati G., Brown J., Wijngaarden E. Differential risk of Clostridium difficile infection with proton pump inhibitor use by level of antibiotic exposure. Pharmacoepidemiol Drug Saf 2011; 20:1035-42.
38. Tleyjeh I.M., Bin Abdulhak A.A., Riaz M., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection: a contemporary systematic review and meta-analysis. PLoS ONE2012; 7(12):e50836.
39. Albright J.B., Bonatti H., Mendez J., Kramer D., Stauffer J., Hinder R., et al. Early and late onset Clostridium difficile-associated colitis following liver transplantation. Transpl Int 2007; 20(10):856-66.
40. Chopra T., Alangaden G.J., Chandrasekar P. Clostridium difficile infection in cancer patients and hematopoietic stem cell transplant recipients. Expert Rev Anti Infect Ther 2010; 8(10):1113-9.
41. Rodríguez Garzotto A., Mérida García A., Muñoz Unceta N., Galera Lopez M.M., Orellana-Miguel M.A., Díaz-García C.V., et al. Risk factors associated with Clostridium difficile infection in adult oncology patients. Support Care Cancer 2015; 23(6):1569-77.
42. Debast S.B., Bauer M.P., Kuijper E.J. on behalf of the Committee. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Suppl. 2):1-26.
43. Abou Chakra C.N., Pepin J., Valiquette L. Prediction tools for unfavourable outcomes in Clostridium difficile infection: a systematic review. PLoS ONE2012; 7:e30258.
44. Kociolek L.K., Gerding D.N. Clinical utility of laboratory detection of Clostridium difficile strain BI/ NAP1/027. J Clin Microbiol 2016; 54(1):19-24.
45. Vardakas K.Z., Konstantelias A.A., Loizidis G., Rafailidis P.I., Falagas M.E. Risk factors for development of Clostridium difficile infection due to BI/NAP1/027 strain: a meta-analysis. Int J Infect Dis 2012; 16(11):768-73.
46. Eyre D.W., Walker A.S., Wyllie D., Dingle K.E., Griffiths D., Finney J., et al. Predictors of first recurrence of Clostridium difficile infection: Implications for initial management. Clin Infect Dis 2012; 55(Suppl. 2):77-87.
47. Hu M.Y., Katchar K., Kyne L., Maroo S., Tummala S., Dreisbach V., et al. Prospective derivation and validation of a clinical prediction rule for recurrent Clostiridium difficle infection. Gastroenterology 2009; 136:1206-14.
48. Kelly J.P. Can we identify patients at high risk of recurrent Clostridium difficile infection? Clin Microbiol Infect 2012; 18(Suppl. 6):21-7.
49. Fekety R., McFarland L.V., Surawicz C.M., Greenberg R.N., Elmer G.W., Mulligan M.E. Recurrent Clostridium difficile diarrhea: Characteristics of and the risk factors for patients enrolled in a prospective, randomized, double-blinded trial. Clin Infect Dis 1997; 24(3):324-33.
50. Samie A.A., Traub M., Bachmann K., Kopischke K., Theilmann L. Risk factors for recurrence of Clostridium difficile-associated diarrhea. Hepatogastroenterology. 2013; 60(126):1351-4.
51. Planche T., Aghaizu A., Holliman R., et al. Diagnosis of Clostridium difficile infection by toxin detection kits: A systematic review. Lancet Infect Dis 2008; 8:777-84.
52. Crobach M.J.T., Planche T., Eckert C., Barbut F., et al.
53. European society of clinical microbiology and infectious diseases: Update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22:63-81.
54. Luo R.F., Banaei N. Is repeat PCR needed for diagnosis of Clostridium difficile infection? J Clin Microbiol 2010; 48:3738-41.
55. Cerilli L.A., Greenson J.K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article. Arch Pathol Lab Med 2012; 136:854-64.
56. Cohen S.H., Gerding D.N., Johnson S., Kelly C.P., Loo V.G., McDonald L.C., et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31(5):431-55.
57. Dinh A., Bouchand F., le Monnier A. Current treatment and epidemiology of Clostridium difficile infections. Rev Med Interne 2015; 36(9):596-602.
58. Hempel S., Newberry S.J., Maher A.R., et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA 2012; 307:1959-69.
59. Johnston B.C., Ma S.S.Y., Goldenberg J.Z., et al. Probiotics for the prevention of Clostridium difficile associated diarrhea. Ann Intern Med 2012; 157:878-88.
60. Шрайнер Е.В., Курилович С.А., Осипенко М.Ф., Власов В.В. Трансплантация кишечной микробиоты: терапевтический потенциал при болезнях органов пищеварения Рос журн гастроэнтерол гепатол колопроктол 2014;24(5):63-8.
61. Chapman B.C., Moore H.B., Overbey D.M., Morton A.P. Fecal microbiota transplant in patients with Clostridium difficile infection: A systematic review. J Trauma Acute Care Surg 2016; 81(4):756-64.
62. Lofmark S., Edlund C., Nord C.E. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clin Infect Dis 2010; 50 (suppl 1):16-23.
63. Aradhyula S., Manian F.A., Hafidh S.A.S., Bhutto S.S., Alpert M.A. Significant absorption of oral vancomycin in a patient with Clostridium difficile colitis and normal renal function. South Med J 2006; 99:518-20.
64. Martirosian G., Rouyan G., Zalewski T., MeiselMikołajczyk F. Dioctahedral smectite neutralization activity of Clostridium difficile and Bacteroides fragilis toxins in vitro. Acta Microbiol Pol 1998; 47(2):177-83.
65. McFarland L.V., Elmer G.W., Surawicz C.M. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol 2002; 97:1769-75.
Источник
Клостридиальный псевдомембранозный колит (С. difficile-ассоциированный колит)Псевдомембранозный или С. difficile-ассоциированный колит представлен широким спектром клинических проявлений от умеренной диареи до фульминантной формы с возможным фатальным исходом. В «доантибиотическую» эру псевдомембранозный колит вызывался различными возбудителями (например, Staphylococcus); в настоящее время наиболее типичной причиной является избыточное размножение симбионтного анаэроба С. difficile на фоне антибиотикотерапии. Патофизиология: гибель нормальных бактерий толстой кишки, вызвванная антибиотиками (от нескольких дней до 10 недель после приема антибиотиков), приводит к колонизации токсинпродуцирующим С. difficile (орально-фекальный путь заражения). Высвобождение токсинов А и В приводит к гибели слизистой и воспалению. В основе различных степеней проявления заболевания лежат: 1) иммунные факторы хозяина и 2) вирулентные факторы микроорганизмов. Антибиотики, связанные с клостридиальным колитом: любые антибиотики (за некоторым исключением, например, ванкомицин); частота возникновения колита в значительной степени является отражением повсеместного использования соответствующих лекарственных препаратов: пенициллинов, цефалоспоринов, фторхинолонов, клиндамицина и даже метронидазола (несмотря на то, что последний применяется для лечения при С. difficile). Лечение: от консервативного (легкие и среднетяжелые формы) до колэктомии (тяжелые и жизнеугрожающие формы), которая может спасти больному жизнь.
а) Эпидемиология: б) Симптомы псевдомембранозного колита: – Заболевание с различной степенью тяжести и динамикой развития (бессимптомное, самокупирующееся/ограниченное кишечником, прогрессирующее/системное, хроническое «тлеющее»/системное, фульминантное, с развитием полиорганной недостаточности): – Осложнения: дилатация толстой кишки (вначале картина как при синдроме Огилви) => токсический мегаколон, перфорация, сепсис, олигурия, полиорганная недостаточность, смерть. – Редкие формы:
в) Дифференциальный диагноз клостридиального колита: г) Патоморфология псевдомембраного колита Микробиология Clostridium difficile: • С. difficile повсеместно распространенный грамположительный анаэроб, образующий устойчивые к нагреванию споры, способные сохраняться в окружающей среде месяцы и годы => отличие патогенных штаммов от непатогенных состоит в способности продуцировать токсины, вызывающие диарею и колит. • Инфицирование происходит при проглатывании спор, которые могут выжить в кислой среде желудка и развиться в вегетативные формы в толстой кишке. • Наличие С. difficile обычно для окружающей среды больниц/учреждений длительного ухода: • Токсины: Макроскопическое/микроскопическое исследование:
д) Обследование при псевдомембранозном колите Необходимый минимальный стандарт: 1. Диарея. Анализ кала на токсины С. difficile А и В (посев С. difficile не показан!). 2. Диарея и абдоминальные/системные или неопределенные симптомы: Дополнительные исследования (необязательные):
е) Классификация псевдомембранозного колита: ж) Лечение без операции псевдомембраного колита 1. Амбулаторно или в стационаре при легких симптомах: 2. Стационар при выраженных сопутствующих заболеваниях/ПИТ: 3. Альтернативы:
и) Операция при псевдомембранозном колите Показания: Хирургический подход. Колэктомия с концевой илеостомой у всех без исключения больных. к) Результаты лечения клостридиального колита: л) Наблюдение и дальнейшее лечение: – Также рекомендуем “Инфекционный энтероколит – причины, признаки, лечение” Оглавление темы “Болезни толстой кишки”:
|
Источник