Особенности выбора конструкционных материалов у лиц с кандидозом

М. О. Нагаева
к. м. н., доцент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
М. Г. Чеснокова
д. м. н., профессор, кафедра микробиологии, вирусологии и иммунологии ГОУ ВПО ОмГМА Минздрава РФ
И. В. Анисимова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
Истинная заболеваемость кандидозом полости рта в России неизвестна, поскольку он официально не регистрируется, поэтому публикации по этой проблеме в отечественной литературе немногочисленны [5]. Колонизация слизистых оболочек грибами Сandida у практически здоровых людей колеблется от 15 до 40 % и может возрасти до 80 % на фоне какой-либо патологии.
Актуальность исследования
Усиленный рост гриба, приводящий к развитию кандидоза, наблюдается при нарушении местного и системного иммунитета.
Возможно и экзогенное заражение. Поверхностный кандидоз слизистых возникает и у практически здоровых лиц. Глубокий кандидоз развивается при тяжелом иммунодефиците на фоне кандидозного стоматита, глоссита или фарингита. Через поврежденную слизистую грибы проникают в кровь, вызывая фунгемию и сепсис.
Лечение кандидоза должно быть индивидуальным для каждого больного с учетом локализации и остроты процесса и возможности наличия хронической стадии заболевания, с учетом иммунного статуса, наличия других заболеваний. Этиотропное лечение является наиболее важной составляющей комплексного лечения больных с кандидозом полости рта. Эрадикация возбудителя — первое мероприятие, после которого можно переходить к профилактике рецидивов и коррекции местных и общих предрасполагающих факторов. Этиотропная терапия может быть местной (в случае изолированного кандидозного поражения полости рта) и системной (при распространении инфекционного процесса на нижерасположенные отделы пищеварительного тракта, кожу, другие слизистые оболочки). Системная терапия кандидоза слизистой оболочки полости рта назначается, как правило, только при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза; кандидоз полости рта на фоне сахарного диабета, иммунодефицитного состояния; при неэффективной местной терапии.
Перечень антигрибковых препаратов огромен, и с каждым годом появляются новые препараты в виде ополаскивателей, растворов, таблетированных форм. Основную группу специфических препаратов составляют антимикотические средства, однако на сегодняшний день чувствительность к ним грибов Candida неодинаковая, а зачастую недостаточная. Тем не менее тесты на чувствительность не считаются рутинной процедурой, не всегда доступны и обычно не рассматриваются как стандартная методика в ведении больного. Тесты на чувствительность считаются полезными в тех случаях, когда мы имеем дело с глубокими инфекциями, обусловленными non-albicans видами Candida. В этих случаях, особенно если больного предварительно уже лечили антифунгальными азолами, должна быть рассмотрена возможность микробиологической резистентности.
Целью нашего исследования явилось определение чувствительности к антимикотикам штаммов грибов рода Сandida, выделенных у больных оральным кандидозом.
Материалы и методы
На базе кафедры терапевтической стоматологии ОмГМА и ГКСП № 1 г. Омска нами проведено клиническое обследование 48 пациентов с жалобами на боль и жжение в слизистой оболочке полости рта. Обследование проводилось согласно алгоритму, предложенному Недосеко В. Б., Анисимовой И. В. (2003) [3].
В комплексном обследовании пациентов проводилось микробиологическое исследование материала, полученного путем соскоба со слизистой оболочки спинки языка. Забор биоматериала осуществлялся до назначения лечебных мероприятий сухим стерильным тампоном без использования транспортной среды. Перед взятием микробиологического материала пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур. Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию. С целью выделения факультативно-анаэробных микроорганизмов, дрожжеподобных грибов рода Candida биоматериал засевали на питательные среды. Готовили серию последовательных двукратных разведений материала с 102 по 1012. Для выделения стафилококков осуществляли посев соответствующих разведений на желточно-солевой агар, для выявления стрептококков проводили посев на кровяной агар с азидом натрия. Для выделения бактерий рода Haemophilus и Neisseria материал засевали на шоколадный агар с линкомицином, энтеробактерий — на среду Эндо, для обнаружения энтерококков использовали энтерококковый агар.
Для выделения грибов рода Candida биоматериал засевали на среду Сабуро, Кандиселект.
Для идентификации грибов оценивали культуральные свойства на среде Кандисилект, биохимическую идентификацию проводили с помощью тест-системы «Ауксоколор».
Для определения чувствительности дрожжеподобных грибов рода Candida к антимикотическим препаратам (нистатин, амфотерицин В, клотримазол, флуконазол, итраконазол) использовали классический дискодиффузионный метод и Фунгитест.
Для постановки дискодиффузионного метода готовили взвесь культуры в изотоническом растворе хлорида натрия, 1 мл взвеси выливали на поверхность среды Мюллера — Хинтона. Учет результатов проводили путем измерения диаметра зоны подавления роста культуры к антимикотику.
Для проведения Фунгитеста готовили суспензию грибов из чистой культуры, выросшей на среде Сабуро, — первый калиброванный инокулят с мутностью, соответствующей стандарту 3 х 106 грибов/мл.
Разведение первичного раствора 1:20 добавляли в суспензионную среду для получения стандартного инокулята (103 КОЕ/мл). Стандартный инокулят вносили в лунки микропланшета. Инкубировали в течение 48 часов.
Результаты исследования и их обсуждение
При обследовании 48 пациентов нами было выявлено 23 пациента с признаками орального кандидоза. Все пациенты предъявляли жалобы на боль, жжение, сухость во рту. У 60,8 % (14 пациентов) выявлялись клинические признаки хронического атрофического кандидоза (рис. 1), у 39,2 % (9 пациентов) был обнаружен хронический гиперпластический кандидоз (рис. 2).
Рис. 1. Пациентка К., 65 лет. Хронический атрофический кандидоз полости рта
Рис. 2. Пациентка И., 69 лет. Хронический гиперпластический кандидоз полости рта. Кандидозная заеда
В результате микробиологического исследования материала из полости рта 23 пациентов выделено и идентифицировано 75 штаммов условно патогенных микроорганизмов (48 штаммов Candida albicans, 27 штаммов условно патогенных бактерий). Большинство выделенных микроорганизмов высевалось в значимых концентрациях (104 КОЕ — 29,3 %, 106 КОЕ 40,0 %, 108 КОЕ — 22,7 %). При этом Candida albicans наиболее часто встречалась в ассоциации с S. epidermidis (104 КОЕ, 106 КОЕ), с E. faecalis (104 КОЕ, 106 КОЕ), S. salivarius (106 КОЕ). В ходе определения чувствительности грибов Candida аlbicans к антимикотическим препаратам выявлено 18 (37,5 %) штаммов с признаками резистентности. Наибольшая устойчивость выделенных штаммов грибов определялась к нистатину (33 % чувствительных штаммов) (рис. 3).
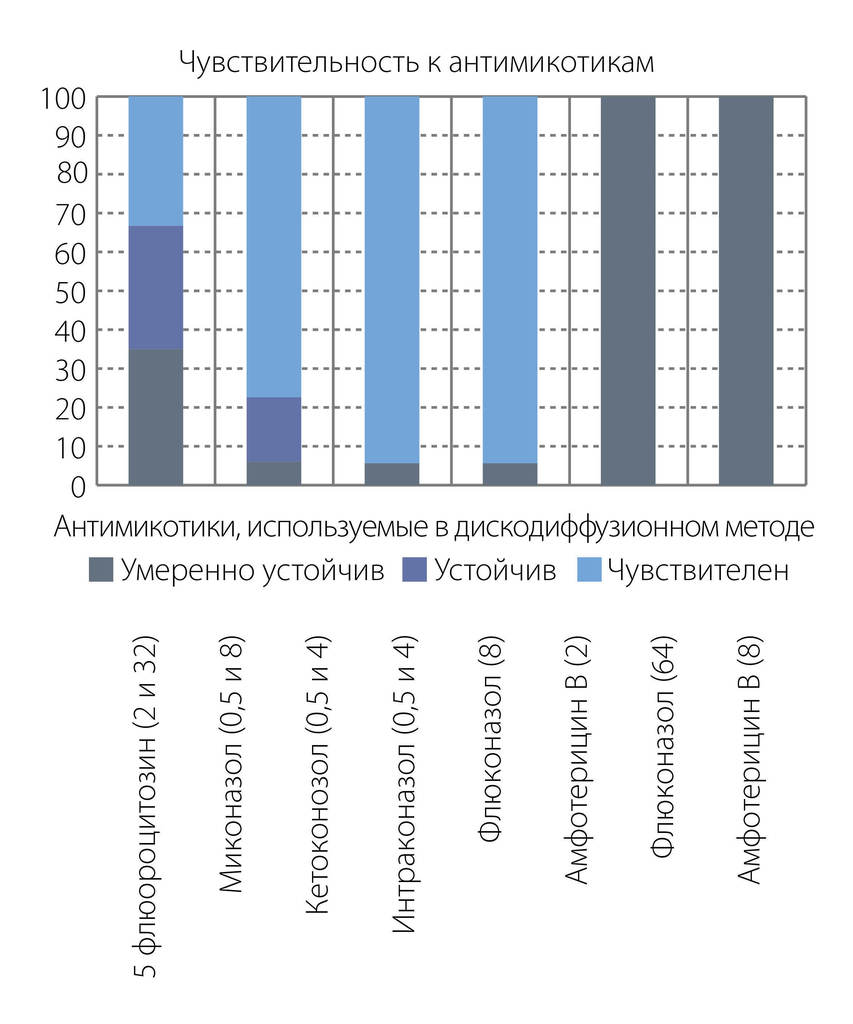
Рис. 3. Чувствительность к антимикотикам в дискодиффузионном методе
Чувствительность Candida аlbicans к итраконазолу, кетоконазолу, 5 флюороцитазину и миконазолу составила 100 % (рис. 3, 4).

Рис. 4. Чувствительность к антимикотикам в методе «Фунгитест»
При определении чувствительности к флуконазолу дискодиффузионным методом выявлено 94,4 % чувствительных к флуконазолу штаммов. При использовании метода «Фунгитест» чувствительность к флуконазолу в концентрации 8 составила 88,8 %, к флуконазолу в концентрации 64 — 100 %. К клотримазолу проявляли чувствительность 94,4 % штаммов C. аlbicans. Все выделенные штаммы были чувствительны к амфотерицину В(64), к амфотерицину В(8) — лишь 66,6 % штаммов. При определении чувствительности дискодиффузионным методом к амфотерицину В проявляли чувствительность 77,4 % исследуемых штаммов.
Заключение
При назначении этиотропного лечения пациентам с оральным кандидозом необходимо учитывать результаты микологического исследования с определением чувствительности к антимикотическим препаратам, так как у выделенных штаммов Candida аlbicans в 37 % случаев выявлена резистентность к антимикотикам. При выборе метода определения чувствительности к противогрибковым препаратам необходимо учитывать, что дискодиффузионный метод является ориентировочным, Фунгитест обладает выраженной специфичностью и высокой чувствительностью. Кроме того, методы отличаются спектром антимикотиков. Таким образом, для обеспечения оптимального выбора противогрибковых препаратов в практике можно рекомендовать использование двух методов — как дискодиффузионного, так и метода «Фунгитест».
Источник
Кандидоз — инфекционное заболевание, обусловленное дрожжеподобными грибами рода Candida. Клинические проявления микоза широко варьируют от поверхностных, слабовыраженных поражений кожи и слизистых оболочек до тяжелых, угрожающих жизни инвазивных висцеральных форм. Диагностика и терапия кандидоза непроста и часто требует привлечения специалистов различного профиля [1, 4, 8].
Число больных поверхностными и глубокими формами кандидоза в последние десятилетия значительно возросло во всех странах мира. Этот факт связывают со снижением естественной иммунной реактивности организма значительной части населения из-за поражения СПИДом, ятрогенных иммунодефицитов, возникающих при химиотерапии онкологических больных, трансплантации органов, вследствие применения глюкокортикоидов, цитостатиков, антиметаболитов, антибиотиков широкого спектра действия, в том числе в отделениях реанимации и интенсивной терапии [4, 8].
Главным возбудителем кандидоза является Candida albicans, которая, как и другие виды грибов Candida, обнаруживается в норме на слизистых и кожных покровах большинства обследованных, но поражает лишь ослабленный организм. Именно в этом кроется сложность проблемы кандидоза.
Природа возбудителя, его взаимоотношения с макроорганизмом, многие аспекты защиты организма от кандидозной инфекции, генетические механизмы резистентности различных видов Candida spp. к основным антимикотикам, применяющимся в лечении кандидоза, подробно изучена. Установлено, что подавляющее большинство штаммов C. albicans, C. tropicalis, C. parapsilosis чувствительны к флуконазолу, однако у ВИЧ-инфицированных и других иммунокомпрометированных больных с инвазивным кандидозом возможна резистентность C. albicans к азольным соединениям. В то же время большинство штаммов C. krusei и часть штаммов C. Glabrata обнаруживают устойчивость к флуконазолу [8].
Известно, что грибы рода Candida сапрофитируют на коже и слизистых оболочках, не вызывая заболевания и лишь при повреждении наружных покровов, снижении местного иммунитета они могут проникнуть внутрь, пройдя стадии адгезии, колонизации и инвазии.
Адгезия грибов Candida обусловлена их способностью расщеплять секреторный иммуноглобулин А и α-антитрипсин и прикреплять жизнеспособный гриб к протеинам слизистых оболочек за счет гликопротеинадгезина клеточной мембраны гриба. Адгезия гриба к эпителию является основой его инвазии в организм, что происходит уже в первые минуты его взаимодействия со слизистой. Степень адгезии определяет уровень колонизации C. albicans, а степень инвазии — его вирулентность. Грибки продуцируют эндотоксины, гемолизины, дермотоксины, пирогены, протеолитические ферменты, облегчающие адгезию грибковых клеток к ороговевшему эпителию и слизистым оболочкам. Установлено, что у разных штаммов C. albicans способность к продукции этих «факторов агрессии», колонизации и инвазии выражена в различной степени, что должно учитываться при назначении лечения [5, 6]. В «Проекте рекомендаций по лечению кандидоза» указано на важность определения вида возбудителей и их чувствительности к противогрибковым препаратам, даются рекомендации по лечению различных форм инвазивного кандидоза, кандидемии и острого диссеминированного кандидоза — тяжелейших форм кандида-инфекции с высокой летальностью, перечисляются показания к проведению адекватного лечения амфотерицином В и флуконазолом [4]. Замена первого дорогостоящим липосомальным препаратом амбизомом позволяет избежать высокой нефротоксичности амфотерицина В и проводить лечение больных кандидозом с почечной недостаточностью, резистентной к антибиотикам фебрильной нейтропенией, при высоком риске развития острого диссеминированного кандидоза у больных без нейтропении, его органных форм (поражения сердца, сосудов, мочевыводящих путей, желудочно-кишечного тракта). В работе также приводятся рекомендации по лечению кандидоза кожи, ее придатков, хронического кандидоза кожи и слизистых оболочек, профилактике кандидоза у реципиентов трансплантатов органов.
Наиболее полное, систематизированное изложение проблемы кандидоза дано в вышедшей в 2000 году монографии «Кандидоз» [8].
Этиотропная терапия любого инфекционного заболевания, в том числе и кандидоза, ставит своей целью удаление (эрадикацию) возбудителя. Однако особенностью кандидоза является то, что грибы рода Candida входят в состав постоянной биоты — нормобиоты, бактериобиоты человека, и легко колонизируют слизистые оболочки, то есть сама эрадикация этого гриба почти никогда не бывает абсолютной и окончательной. Учитывая оппортунистическую природу кандида-инфекции, саму эрадикацию возбудителя связывают с патогенетическими факторами, определяющими клиническую форму и тяжесть инфекции. Это иммунодефициты, нейтропения и другие. Вот что определяет выбор антимикотика, его дозу и длительность терапии.
Лечение может быть направлено на предупреждение гиперколонизации организма грибами рода Candida (при назначении антимикотиков широкого спектра действия и иммуносупрессантов). Местные оральные антимикотики — полиены (нистатин, леворин, микогептин) нерастворимы и почти не всасываются из желудочно-кишечного тракта, поэтому редко могут обеспечить элиминацию Candida. Здесь необходимы пероральные препараты системного действия (флуконазол, итраконазол) или препараты для инъекций, такие как флюцитозин, амфотерицин В, амбизом. Если амфотерицин В вследствие его чрезвычайной нефротоксичности назначается при кандидозе в суточной дозе 0,5 мг/кг массы тела, амбизом в 10 раз и более превышает эту дозу и не имеет противопоказаний к назначению [1, 2, 3, 4, 9, 10]. При лечении кандидозов кожи и слизистых оболочек часто используются антимикотики для наружного применения: полиены (леворин, нистатин, натамицин), производные имидазола (кетоконазол, оксиконазол, эконазол, тиоконазол, клотримазол, миконазол, изоконазол, бифоназол, амиказол), триазолы (терконазол), аллиламины (нафтифин, тербинафин), морфолины (аморолфин), прочие препараты (производные унденциленовой кислоты, анилиновые красители и др.).
Одно только перечисление антикандидозных препаратов уже свидетельствует об их множестве и разной степени эффективности, связанной с химической структурой и особенностями фармакокинетики. В частности, наружные средства не всегда создают достаточную концентрацию в подслизистом слое половых путей, глубоких слоях кожи и ее придатках.
В последние годы в России и за рубежом в системной терапии кандидоза с успехом применяется медофлюкон (флуконазол) [2, 3].
Флуконазол (медофлюкон) — противогрибковый препарат из группы триазолов, эффективный при системных и локальных микозах. Флуконазол избирательно подавляет синтез эргостерина клеточной мембраны грибков на уровне образования диметил-эргостатриенола из ланостерина путем ингибирования зависимой от цитохрома Р-450 реакции С14-альфа-демитиляции. Этот путь биосинтеза стеролов характерен только для грибов. За счет более высокого сродства к ферментам, катализирующим синтез эргостерина у грибов, чем к ферментам, катализирующим образование холестерина у человека, селективность действия флуконазола на грибы рода Candida, дерматофиты и возбудители глубоких микозов в 10 000 раз выше, чем на клетки макроорганизма.
Спектр фунгистатического действия флуконазола: Candida albicans, некоторые штаммы Candida nonalbicans (C. guilliermondii, C. pseudotropicalis, C. torulopsis, C. kefyr, C. stellatoidea), Cryptococcus neoformans, Microsporum spp., Trichophyton spp., Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum.
При пероральном и внутривенном применении фармакокинетика флуконазола сходная. При приеме внутрь биодоступность около 90%. Прием пищи не влияет на абсорбцию препарата. Максимальная концентрация достигается через 0,5 — 1,5 ч. После приема 150 мг она составляет 2,44 — 3,58 мкг/мл. Концентрация в крови прямо пропорциональна принятой дозе. Равновесная концентрация устанавливается к 4 — 5-му дню при приеме 1 раз в сутки. При использовании в первый день двойной дозы она достигается ко второму дню. Связь с белками плазмы 11 — 12%. Объем распределения приближается к общему объему воды в организме. Концентрации флуконазола в слюне, мокроте, суставной и перитонеальной жидкостях, вагинальном секрете, грудном молоке аналогичны таковым в плазме крови. Концентрация в ликворе составляет 50 — 90% (в среднем 70 — 80%) уровня в плазме крови, при менингите — до 93%. В роговом слое кожи, эпидермисе, дерме, потовой жидкости и моче концентрации достигают значений, в 10 раз превышающих концентрацию в плазме крови. Концентрация в роговом слое кожи после 12-дневного применения в дозе 50 мг 1 раз в сутки составляет 73 мкг/г. Концентрация в ногтях после 4-месячного применения в дозе 150 мг 1 раз в неделю составляет 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных ногтях. Препарат определяется в ногтях в течение 6 месяцев после завершения терапии. Т1/2 27 — 30 ч. Биотрансформации не подвергается. Экскретируется почками, на 80% — в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Концентрация флуконазола в плазме крови может быть уменьшена с помощью диализа (на 50% в течение 3 ч).
Медофлюкон применяется внутрь 1 раз в сутки (утром).
Дозы для взрослых:
- При кандидемии, диссеминированном кандидозе — 400 мг в первые сутки и 200 — 400 мг — в последующие дни. Продолжительность лечения 7 — 14 дней и более.
- При кандидозе кожи — 50 — 100 мг 1 раз в сутки или 150 мг 1 раз в неделю в течение 2 — 6 недель.
- При орофарингеальном кандидозе — 50 мг в сутки в течение 7 — 14 дней.
- При кандидозе другой локализации (кандидурии, кандидозном эзофагите и неинвазивном бронхолегочном кандидозе) — 50 — 150 мг в сутки в течение 14 — 30 дней.
- При онихомикозе — 50 мг 1 раз в сутки или 150 мг 1 раз в неделю в течение 3 — 6 месяцев при поражении ногтей пальцев рук и 6 — 12 месяцев — при поражении ногтей пальцев ног (до замещения инфицированного ногтя).
- При кандидозном баланопостите или вагинальном кандидозе — 150 мг однократно, при кандидозном вульвовагините — 50 мг в сутки в течение 7 дней или 150 мг двукратно, при хроническом рецидивирующем (3 — 4 раза в год или чаще) кандидозном вульвовагините 150 мг 3 — 4 раза в сутки с 3 — 7-дневными интервалами, иногда до 12 раз с месячными интервалами.
- При глубоких эндемических микозах — 200 — 400 мг в сутки ежедневно до 2 лет: 11 — 24 мес. при кокцидиомикозе, 2 — 17 мес — при паракокцидиомикозе, 1 — 16 мес. — при споротрихозе, 3 — 17 мес — при гистоплазмозе.
- При криптококковом менингите, криптококковых инфекциях другой локализации — 400 мг в первые сутки и 200 — 400 мг в последующие дни. Продолжительность лечения 7 — 14 дней, при криптококковом менингите — до 6 — 8 недель.
- Для профилактики грибковых инфекций — 50 — 400 мг в сутки на протяжении всего периода антибактериальной, глюкокортикоидной, цитостатической или лучевой терапии.
Специального подбора доз для пациентов пожилого возраста не требуется, если не угнетена функция почек (клиренс креатинина менее 40 — 50 мл/мин).
У больных с нарушениями функции почек доза должна быть снижена в соответствии со степенью почечной недостаточности.
Пациентам, находящимся на гемодиализе: однократно после каждого сеанса гемодиализа.
Российские авторы [3] приводят собственные данные о применении медофлюкона при различных поражениях, в том числе при висцеральных микозах, обусловленных грибами рода Candida. В частности, опубликованы данные об успешном лечении медофлюконом 9 больных кандидозом кишечника, 11 — полости рта, 3 — пищевода, 18 — вагинальным кандидозом при суточной дозе 50 — 200 мг и длительности курса 14 дней. Отечественные исследователи, оценив эффективность и безопасность препарата, уже в 1996 году назвали медофлюкон безусловным достижением в лечении кандидоза и рекомендовали его для лечения поверхностных и висцеральных форм микоза не только в стационаре, но и в амбулаторных условиях.
К такому же выводу пришли и авторы, проводившие исследования медофлюкона в Московском центре глубоких микозов [2]. По их данным, из 79 больных кандидозным бронхитом, получавших в течение 2 недель 100 — 400 мг медофлюкона в сутки, излечено 74,7%, улучшение наступило у 22,8%, при кандидозной пневмонии выздоровело 66,75%, улучшение отмечено у 33,3%, эрадикация возбудителя — в 97,5 — 100%.
В дерматовенерологии медофлюкон наиболее часто применяется при лечении урогенитальных кандидозов, кандидоза слизистой оболочки полости рта, онихомикозах [4, 6, 7, 8].
Данные, приведенные из литературы, и наш опыт применения медофлюкона при кандидозном вульвовагините и онихомикозе свидетельствуют о его высокой эффективности, хорошей переносимости и безопасности, что делает флуконазол препаратом выбора при лечении различных форм кандидоза слизистых оболочек, кожных покровов и внутренних органов.
В. М. Лещенко, доктор медицинских наук, профессор
Городской микологический центр, Москва
Литература
- Бурова С. А. Проблемы грибковых заболеваний человека//Российский журнал кожных и венерических болезней. 1999. № 1. С. 39 – 41.
- Воинова Г. В., Бурова С. А. Опыт лечения пневмомикозов медофлюконом//Пульмонология. 2001. № 1. С. 35 – 36.
- Ивлева А. Я., Поплавко Р. М., Лешкова В. М. и др. Медофлюкон (флуконазол) – последнее достижение в лечении микозов//Медико-фармацевтический вестник. 1996. № 9 – 10. С. 23 – 27.
- Климко Н. Н., Васильева Н. В., Антонов В. Б. и др. Проект рекомендаций по лечению кандидоза//Проблемы медицинской микологии. 2001. Т. 3. № 3. С. 12 – 25.
- Климко Н. Н., Васильева Н. В., Елинов Н. П. и др. Перечень основных методов и критериев диагностики микозов. СПб., 2001. 24 с.
- Лещенко В. М., Лещенко Г. М. Флюкостат – отечественный системный антимикотик//Новые лекарственные препараты в практике дерматовенетолога. М., 2001. С. 68 – 69.
- Лещенко В. М., Богуш П. Г., Важбин Л. Б. и др. Лечение микозов флюкостатом // Вестник последипломного образования. 2002. № 1. С. 51.
- Сергеев А. Ю., Сергеев Ю. В. Кандидоз. М., 2001. 472 с.
- Henderson J. R. Fluconazol – a significant advance in the management of human fungal disease//A. Framtung (Ed.) Discovery, Development and Evaluation of Antifungal Agents. 1987. P. 77 – 79.
- De Wit S., Weerts D., Gossens H. Comparison of fluconazole and ketokonazole for orofaringeal candidosis in AIDS //Lancet. 1989. P. 746 – 749.
Источник
