Некротизирующий колит у новорожденного
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения
Некротический энтероколит новорожденных или «болезнь выживших недоношенных» – это гетерогенная патология, которая характеризуется развитием язв и некрозов стенки кишечника с дальнейшей перфорацией. Более 90% больных детей – недоношенные, с массой тела до 1500г. Общая заболеваемость составляет 0,5-3 на 1000 новорожденных. Прогноз, как правило, неясен, т. к. для НЭК характерно резкое ухудшение состояния на фоне мнимого благополучия. Часто требуется хирургическое вмешательство. Летальность в зависимости от формы колеблется от 25 до 55%. Даже после успешного проведения операции показатель смертности составляет свыше 60%. При условии выживания ребенка наблюдается тяжелый период реабилитации, остается высокий риск послеоперационных осложнений.

Некротический энтероколит новорожденных
Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Ишемия кишечника может быть обусловлена внутриутробной асфиксией плода, при которой наблюдается централизация кровообращения, постановкой катетера в пупочную артерию, влекущей за собой спазм артерий и их тромбоэмболию, явлением «сгущения крови» и артериальной гипотензией, при которых нарушается ток крови и поступление питательных веществ. К алиментарным причинам развития некротического энтероколита новорожденных относят питание ребенка искусственными смесями и их резкую смену, использование гипертонических растворов, повреждающих слизистую оболочку кишечника, врожденную непереносимость молока, непосредственную инвазию патогенных агентов через ЖКТ. Наиболее часто причиной НЭК становятся Kl. pneumonia, E. coli, клостридии, стафилококки, стрептококки и грибы рода Candida.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
- Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
- Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
- Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
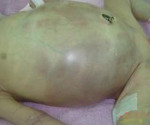
В группу соматических симптомов входят патологические реакции организма на развитие НЭК: приступы апноэ, респираторный дистресс, олигурия, ухудшение микроциркуляции (позитивный симптом «белого пятна»). К абдоминальным признакам НЭК относятся симптомы раздражения брюшной полости и дисфункция ЖКТ: потеря аппетита, метеоризм, рвота желчью и кровью, отсутствие перистальтических шумов, мелена, асцит, покраснение кожи, отечность подкожной жировой клетчатки и резкое напряжение мышц передней брюшной стенки. Нарушения в организме ребенка, возникшие в результате прогрессирования некротического энтероколита новорожденных, объединяют в группу генерализованных проявлений. Сюда входят гипертермия, переходящая в гипотермию, артериальная гипотония, бледность и диффузный цианоз, выраженная вялость и сонливость, ДВС-синдром, дыхательная и сердечно-сосудистая недостаточность.
Большинство осложнений некротического энтероколита новорожденных, как правило, развиваются после проведенного хирургического лечения. Наиболее часто после оперативного вмешательства возникает кишечный свищ, синдром «укороченной кишки», хроническая диарея, демпинг-синдром, обезвоживание, синдром мальабсорбции, стриктура толстого кишечника, абсцесс, задержка физического развития. Также при НЭК могут встречаться патологические состояния, вызванные полным парентеральным питанием: дефицит витамина D (рахит), поражение печени (гепатит) и костей (деминерализация).
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
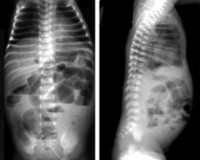
Ведущую роль в диагностике некротического энтероколита новорожденных играют инструментальные методы: рентгенография, УЗИ, КТ и МРТ. Они дают возможность визуализировать отек стенок кишечного тракта, плюс-ткань, наличие воздуха в брюшной полости, в просвете портальной или печеночной вен, а также отсутствие перистальтики на серии последовательных снимков. В педиатрии для подтверждения диагноза «некротический энтероколит новорожденных» и определения стадии заболевания применяется шкала Walsh и Kliegman. При использовании данной шкалы учитываются присутствующие у ребенка соматические симптомы, проявления со стороны желудочно-кишечного тракта и рентгенологические признаки. В зависимости от количества и выраженности проявлений выделяют подозреваемый НЭК (1а и 2а ст.), явный НЭК (2а и 2б ст.), прогрессирующий НЭК (3а и 3б ст.). Это имеет существенное значение при выборе тактики лечения.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Детям с 2б, 3а и 3б стадиями показано хирургическое вмешательство. Объем операции зависит от распространенности поражения кишечника. Как правило, проводится экономная резекция пораженного участка с формированием энтеростомы или колостомы. При локальных формах НЭК возможно наложение анастомоза по типу «конец в конец». После операции назначается инфузионная терапия и медикаментозное лечение, аналогичное более ранним стадиям.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Источник
Некротизирующий энтероколит – это самая частая гастроинтестинальная патология у недоношенных новорожденных, требующая экстренного вмешательства и неотложной терапии. Частота данного состояния варьирует от 10 до 25%. Около 1/3-1/2 всех детей, рождающихся с крайне низкой массой тела, имеют симптомы некротизирующего энтероколита. Примерно половина детей с установленным диагнозом нуждается в хирургическом лечении даже при своевременной диагностике и правильной терапии, летальность составляет 25-30%. Около 10% случаев заболевания диагностируется у доношенных новорожденных.
Сроки начала заболевания находятся в обратной зависимости от гестационного возраста. У доношенных новорожденных некротизирующий энтероколит манифестирует на 3-4-й день жизни; у детей, родившихся ранее 28 недель гестации – на 3-4-й неделе. Заболевание в 10 раз чаще встречается у новорожденных, вскармливаемых энтерально, по сравнению с детьми, не получавшими энтерального питания. При вскармливании искусственными смесями частота энтероколита выше, чем при вскармливании грудным молоком. Тем не менее, заболевание встречается и у тех детей, кто не вскармливался энтерально, и у тех, кто получал грудное молоко.
Причины возникновения
В большинстве отделений интенсивной терапии новорожденных некротизирующий энтероколит носит эпидемический характер. Вспышки заболевания ассоциируются с рядом микроорганизмов – Klebsiella pneumoniae, Escherichia coli, Clostridia, коагулазо-отрицательным стафилококком, ротавирусом. Так как не существует единой универсальной причины развития энтероколита, принято выделять ряд факторов риска, предрасполагающих к заболеванию, а именно: ишемия кишечника, незрелость механизмов защиты, энтеральное кормление.
Роль ишемии в патогенезе некротизирующего энтероколита у новорожденных подтверждается данными о его частой ассоциации с такими факторами, как низкая оценка по шкале Апгар, катетеризация пупочных сосудов, полицитемия, сниженный кровоток в большом круге кровообращения. Принято считать, что при состояниях гипоксии или гипотензии происходит перераспределение кровотока с централизацией кровообращения и гипоперфузией органов брюшной полости. Несмотря на отсутствие прямой причинно-следственной зависимости между гипоксией и некротизирующим энтероколитом, существуют различия в регуляции сосудистого тонуса и кровотока у недоношенных и зрелых детей. Кишечник у недоношенных детей более чувствителен к повреждающему действию гипоксии и свободных радикалов кислорода, оказывающих отрицательный эффект на ткани в период их реперфузии. При катетеризации пупочных сосудов и повышении давления в портальной системе может происходить снижение кровотока в подвздошной или толстой кишке. Эмболия катетера может приводить к эмболии мезентериальных артерий. Введение препаратов кальция в сосуды пуповины может вызывать вазоспазм. Некротизирующий энтероколит также описан у детей, получавших индометацин с целью закрытия артериального протока.
Механизмы местной защиты у недоношенных новорожденных отсутствуют или функционально незрелы, что облегчает колонизацию кишечника патогенной микрофлорой. В патогенезе некротизирующего энтероколита рассматривается роль медиаторов воспаления, в частности фактора, активирующего тромбоциты. Данный фактор синтезируется лейкоцитами, стимулирует высвобождение комплемента, кислородных радикалов, катехоламинов, простагландинов, тромбоксана, лейкотриенов. Плазменные концентрации этого фактора выше у детей, перенесших энтероколит, по сравнению со здоровыми новорожденными. Более того, повышению концентрации фактора способствует энтеральное питание. В свою очередь, защитные факторы грудного молока (иммуноглобулины, антибактериальные агенты) могут оказывать протективное действие в отношении развития заболевания.
Симптомы и диагностика
Клинические симптомы некротизирующего энтероколита у новорожденных достаточно вариабельны. К наиболее распространенным относятся такие признаки, как вздутие (увеличение) живота, рвота, поступление желчи через назогастральный зонд, учащение и разжижение стула, наличие неизмененной крови в испражнениях. При аускультации перистальтика кишечника не выслушивается вследствие развития динамической кишечной непроходимости (пареза). Общая симптоматика включает нестабильность температуры, апноэ, снижение спонтанной двигательной активности, гипотензию. Повышение давления в брюшной полости вследствие вздутия кишечника может приводить к респираторным нарушениям. Данные симптомы развиваются остро или постепенно.
В диагностике заболевания используется прежде всего обзорная рентгенография брюшной полости.
К неспецифическим признакам, обнаруживающимся при некротизирующем энтероколите у новорожденных, относятся расширение петель кишечника, утолщение его стенок, наличие выпота в полости брюшины. Диагностическим симптомом заболевания считается наличие интестинального пневматоза. Эти изменения обусловлены скоплением в кишечной стенке водорода как продукта бактериального метаболизма. Может наблюдаться линейная полоска газа внутри стенки, расположенная либо изолированно в тонкой кишке, либо распространяющаяся и на толстую кишку. Другой рентгенологический симптом – наличие пузырей газа в просвете кишечника. Если заболевание осложняется перфорацией, рентгенологически определяется пневмоперитонеум (наличие полосок свободного газа в брюшной полости). При развитии перитонита определяется затемнение в нижних отделах живота, смещение кишечных петель кверху.
Лечение
Целью лечения некротизирующего энтероколита у новорожденных детей прежде всего является ограничение прогрессирования заболевания. Если ребенок вскармливался энтерально, такое кормление прекращается, проводится декомпрессия желудка. Назначаются антибиотики широкого спектра действия с учетом их эффекта в отношении нозокомиальной флоры. К таким препаратам относятся цефалоспорины 2-3-го поколений (цефокситин, цефтазидим), аминогликозиды 3-го поколения (тобрамицин, амикацин, нетромицин), карбапенемы (тиенам, меронем), дополнительно могут назначаться антистафилококковые антибиотики (ванкомицин).
При появлении признаков перфорации кишечника в лечение включаются антианаэробные препараты (метронидазол, клиндамицин). Обеспечивается центральный венозный доступ и проводится парентеральное питание. Так как в результате воспалительного процесса в кишечнике происходит значительная секвестрация жидкости в третьем пространстве, необходимо проводить коррекцию гиповолемии коллоидными и кристаллоидными препаратами (свежезамороженная плазма, альбумин, глюкозо-солевые растворы) в течение первых 2 — 3-х суток, а также поддерживать стабильную гемодинамику и периферическую перфузию введением инотропных препаратов (дофамин). При появлении респираторных нарушений возможен перевод детей на вспомогательную или искусственную вентиляцию легких.
Рентгенологический контроль может проводиться каждые 6-8 часов в течение первых 2-3 дней заболевания. Около 1/4-1/2 больных требуют хирургического вмешательства. Наиболее важное показание к операции – наличие пневмоперитонеума. Другими показаниями могут быть: клиническое ухудшение, наступающее несмотря на проводимую агрессивную терапию; наличие газа в системе воротной вены и постоянно расширенных петель кишечника на серии рентгенограмм; признаки перитонита или гангрены кишечника. Цель операции заключается в иссечении некротизированного кишечника и ревизии брюшной полости.
При благоприятном течении заболевания возобновление энтерального кормления возможно через 10-14 дней.
Осложнения
Среди половины выживших детей возможны отдаленные осложнения – стриктуры кишечника и синдром короткой кишки. Стриктуры формируются вследствие фиброза и наиболее часто локализуются в толстой кишке. У таких детей через 2-3 недели после выздоровления повторно развивается вздутие живота. Как правило, наличие стриктур требует их хирургического иссечения. Вследствие резекции участков кишечника у детей может наблюдаться синдром мальабсорбции и синдром короткой кишки.
Нормальная длина тонкого кишечника у новорожденных составляет 2-3 м. Наиболее распространенной причиной развития синдрома короткой кишки становится резекция его участков при некротизирующем энтероколите, завороте средней кишки, атрезиях тощей или подвздошной кишки, гастрошизисе. Укорочение кишечника приводит к уменьшению площади поверхности, с которой осуществляется абсорбция нутриентов и электролитов. Резекция илеоцекального сегмента приводит к более серьезным нарушениям, так как вследствие отсутствия илеоцекального клапана возможен рефлюкс из толстой кишки в тонкую с колонизацией ее толстокишечной микрофлорой. Адаптация кишечника после резекции заключается в его умеренной дилатации, гипертрофии слизистой оболочки, что увеличивает площадь всасывания на единицу длины кишечника. По мере роста ребенка длина кишечника также увеличивается. Увеличение размера и усиление функциональной активности слизистой оболочки более характерно для подвздошной кишки по сравнению с тощей кишкой. Окончательно процессы адаптации могут не завершаться и к 2 годам. Тем не менее, в неонатальном периоде крайне важно осуществлять правильное ведение таких детей для становления нормальной функции кишечника в последующем.
При синдроме короткой кишки могут развиваться стеаторея, дефицит витаминов и некоторых микроэлементов, поскольку всасывание солей желчных кислот, жирорастворимых витаминов и минералов осуществляется в дистальной части подвздошной кишки. Для уменьшения стеатореи используется холестирамин – ионообменная смола, связывающая соли желчных кислот. Мальабсорбцию жиров следует устранять их дополнительным энтеральным либо парентеральным введением. Необходимо также осуществлять дополнительное введение витаминов А, D, E, K, В12, цинка и магния. После резекции кишечника возможно повышение секреторной активности желудка. Для профилактики данного состояния, которое может способствовать формированию низкой pH в двенадцатиперстной кишке и инактивации панкреатических ферментов, применяются H2-блокаторы (циметидин). При избыточной колонизации тонкого кишечника толстокишечной микрофлорой может нарушаться всасывание жиров, витамина В12, возможно снижение уровней мальтазы, лактазы, сахаразы, энтерокиназы, что приводит к диарее вследствие мальабсорбции. В данной ситуации назначаются циклические курсы антибактериальной терапии.
Информация, представленная в данной статье, предназначена исключительно для ознакомления и не может заменить профессиональную консультацию и квалифицированную медицинскую помощь. При малейшем подозрении о наличии данного заболевания обязательно проконсультируйтесь с врачом!

Источник
