Глюкозо аланиновый цикл кори
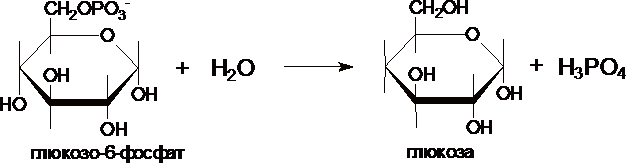
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
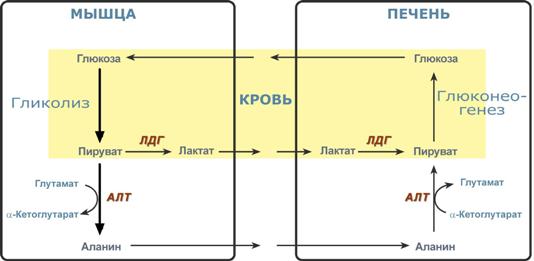
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
Глюкозо-лактатный
цикл –
это циклический процесс, объединяющий
реакции глюконеогенеза и реакции
анаэробного гликолиза. Глюконеогенез
происходит в печени, субстратом для
синтеза глюкозы является лактат,
поступающий в основном
из эритроцитов или мышечной
ткани.
В эритроцитах молочная
кислота образуется непрерывно, так как
для них анаэробный гликолиз является
единственным способом образования
энергии.
В скелетных
мышцах высокое
накопление молочной кислоты (лактата)
является следствием гликолиза при очень
интенсивной, субмаксимальной мощности,
работе, при этом внутриклеточный рН
снижается до 6,3-6,5. Но даже при работе
низкой и средней интенсивности в
скелетной мышце всегда образуется
некоторое количество лактата.
Убрать
молочную кислоту можно только одним
способом – превратить ее в пировиноградную
кислоту. Однако сама мышечная клетка
ни при работе, ни во время отдыха не
способна превратить лактат в пируват
из-за особенностей изофермента
лактатдегидрогеназы-5. Зато клеточная
мембрана высоко проницаема для лактата
и он движется по градиенту концентрации
наружу. Поэтому во время и после нагрузки
(при восстановлении) лактат легко
удаляется из мышцы. Это происходит
довольно быстро, всего через 0,5-1,5 часа
в мышце лактата уже нет. Малая часть
молочной кислоты выводится с мочой.
Большая
часть лактата крови захватывается
гепатоцитами, окисляется в пировиноградную
кислоту и вступает на путь глюконеогенеза.
Глюкоза, образованная в печени используется
самим гепатоцитом или возвращается
обратно в мышцы, восстанавливая во время
отдыха запасы гликогена. Также она может
распределиться по другим органам.
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
35.
Биохимические аспекты сахарного диабета,
как самого распространенного нарушения
углеводного обмена.
Стр.
-174, Губский
36.
Биохимические основы возникновения
основных клинических проявлений
сахарного диабета.Глюкозотолерантный
тест.
Стр.
174-175 , Губский
37.
Липиды. Биологическая роль. Классификация.
Стр.
348 – Гонский
38.
Высшие жирные кислоты. Роль полиненасыщенных
жирных кислот в организме.
Стр.
349 , –
Гонский
39.
Роль липидов в организме человека.
Жиры
входят в состав всех клеток организма
и участвуют в ряде обменных процессов,
являются «запасными» клетками организма,
выполняющими функции по аккумуляции
химической энергии и использованию ее
при недостатке пищи.
Липиды
состоят из жирных кислот, которые делятся
на насыщенные и ненасыщенные.
Насыщенные
жирные кислоты
Насыщенные
— содержатся преимущественно в животных
жирах, а также могут частично синтезироваться
из углеводов и даже из белков. Именно
избыток насыщенных жирных кислот в
питании человека приводит к нарушению
обменных жировых процессов, повышению
уровня холестерина в крови.
Растительные
жиры содержат в основном ненасыщенные
кислоты. В некоторых растительных
продуктах их содержится достаточно
много, например, в орехах — 65 %, в овсяной
крупе — 7 %, в гречневой крупе — 3 %.
Ненасыщенные
жирные кислоты
Ненасыщенные
жирные кислоты, особенно такие, как
линолевая, линолиновая и арахидоновая,
играют важную роль в обменных процессах
организма человека. Они не могут
синтезироваться и потому являются
незаменимыми и должны поступать в
организм извне. Ненасыщенные жирные
кислоты входят в состав клеточных
мембран и других структурных элементов
тканей и участвуют в обменных реакциях,
обеспечивая процессы роста, нормальные
структурные функции, нормальное строение
капилляров, их проницаемость, что
особенно важно в протекании тканевых
процессов. Ненасыщенные жирные кислоты
способствуют удалению холестерина из
организма, тем самым препятствуя развитию
атеросклероза. Потребность организма
в полиненасыщенных жирных кислотах
составляет 20–25 г в сутки, и за счет этих
кислот необходимо обеспечивать до 5 %
общей калорийности рациона питания
человека.
Фосфолипиды
— лецитин, холин, кефалины, также
участвуют в регуляции холестеринового
обмена, препятствуют накоплению
холестерина, то есть обладают липотропным
действием. Больше всего фосфолипидов
в зерне, бобовых, нерафинированных
растительных маслах, картофеле.
40.
Классификация липидов. Охарактеризуйте
особенности строения и функции различных
классов липидов.
Стр.
348 – Гонский
41.
Классификация липидов. Сложные липиды,
их строение и роль.
Стр.
348, Гонский
Сложные
липиды – помимо жирных кислот и спиртов
содержат другие компоненты различной
химической природы. К ним относятся
фосфолипиды и гликолипиды.
Стр.
352-355, Гонский
42.
Переваривание и всасывание липидов в
пищеварительном тракте; ресинтез жира
в клетках кишечника; транспортные формы
липидов.
Стр.
– 357, Гонский
43.
Химический состав и функции желчи.
Желчные кислоты. Структура, биологическая
роль.
Стр.-
357,Гонский абзац -3
44.
Превращение жирных кислот в тканях.
b-окисление, его связь с общими путями
катаболизма; энергетический эффект.
Стр.-366,
Гонский
45.
Биосинтез жирных кислот: последовательность
реакций, локализация процесса,
характеристика ферментов.
Стр.
– 201, Губский, 373, 382 – Гонский
46.
Кетогенез и кетолиз; причины кетоза и
нетоацидоза у больных сахарным диабетом
и голодающих; диагностическое определение
ацетона в моче.
Стр.
371- Гонский, 197 –Губский
47.
Кетоновые тела. Химическая природа;
роль, диагностическое определение
кетоновых тел в моче.
Стр.
– 198, Губский
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Глюкоза
+ 2 АДФ + 2 H3PO4 =
2 Лактат + 2 АТФ + 2 Н2О
В
анаэробном гликолизе АТФ образуется
только за счет субстратного фосфорилирования
(2
моль АТФ на 1моль глюкозы).
Значение
анаэробного гликолиза особенно велико
для скелетных мышц. В интенсивно
работающих скелетных мышцах мощность
механизма транспорта кислорода
оказывается недостаточной для обеспечения
энергетической потребности, в этих
условиях резко усиливается анаэробный
гликолиз, и в мышцах накапливается
молочная кислота. Особое значение
анаэробный гликолиз имеет при
кратковременной интенсивной работе.
Так, бег в течение 30 с полностью
обеспечивается анаэробным гликолизом.
Однако уже через 4-5 мин бега энергия
поставляется поровну анаэробным и
аэробным процессами, а через 30 мин –
почти целиком аэробным процессом. При
длительной работе в аэробном процессе
используется не глюкоза, а жирные
кислоты.
Эритроциты
вообще не имеют митохондрий, поэтому
их потребность в АТФ удовлетворяется
только за счет анаэробного гликолиза.
Интенсивный гликолиз характерен также
для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и глюкозо-аланиновый цикл.
Молочная
кислота не является конечным продуктом
обмена, но ее образование – тупиковый
путь метаболизма: ее дальнейшее
использование связано опять с превращением
в пируват. Из клеток, в которых происходит
гликолиз, образующаяся молочная кислота
поступает в кровь и улавливается в
основном печенью, где и превращается в
пируват. Пируват в печени частично
окисляется, а частично превращается в
глюкозу. Часть пирувата в мышцах путем
трансаминирования превращается в
аланин, который транспортируется в
печень, и здесь снова образует пируват.
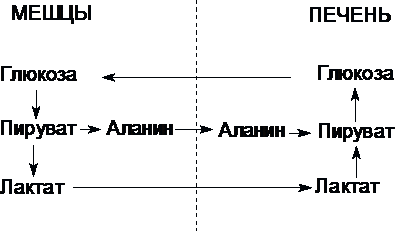
Рис.
Цикл Кори и глюкозо-аланиновый цикл
Биосинтез глюкозы (глюконеогенез).
Глюконеогенез
протекает в основном по тому же пути,
что и гликолиз, но в обратном направлении.
Однако три реакции гликолиза необратимы,
и на этих стадиях реакции глюконеогенеза
отличаются от реакций гликолиза.
Обходные пути глюконеогенеза.
I.
Первый обходной путь – превращение
пирувата в фосфоенолпируват.
Это
превращение осуществляется под действием
двух ферментов – пируваткарбоксилазы
(Е1) и карбокикиназы
фосфоенолпирувата (Е2).
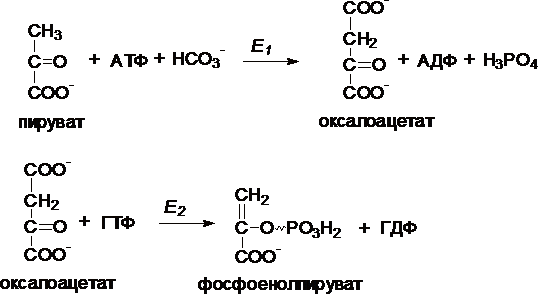
II. Превращение
фруктозо-1,6-дифосфата во
фруктозо-6-фосфат катализирует
фермент фруктозо-1,6-дифосфатаза.
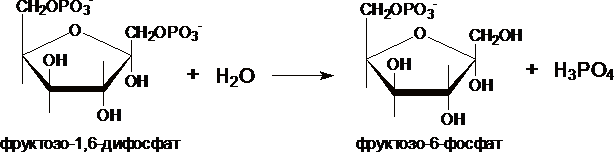
III. Образование
глюкозы из глюкозо-6-фосфата катализирует
фермент глюкозо-6-фосфотаза .
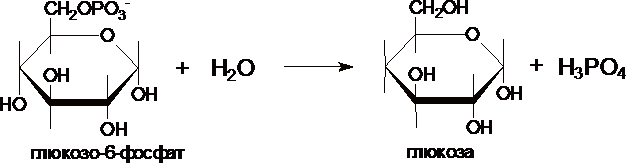
Этот
фермент отсутствует в клетках мозга,
скелетных мышц и др. тканях, поэтому
глюконеогенез, протекающий в этих тканях
не может поставлять глюкозу в кровь.
Глюкозо-6-фосфатаза локализована в
почках и, особенно, в печени, и
глюкозо-6-фосфат может превращаться в
глюкозу, если ее уровень в крови снижен.
Пентозофосфатный путь (пфп). Значение пфп.
Большая
часть глюкозы расщепляется по
гликолитическому пути. Наряду с гликолизом
существуют второстепенные пути
катаболизма глюкозы, одним из которых
является пентозофосфатный путь (ПФП).
Пентозофосфатный путь скорее даже –
анаболический путь, который использует
6 атомов С глюкозы для синтеза пентоз и
восстановительных эквивалентов в виде
НАДФН, необходимых для образования
липидов в организме. Однако, этот путь
– окисление глюкозы, и при определенных
условиях может завершиться полным
окислением глюкозы до СО2 и
Н2О.
Главные функции этого цикла следующие:
Генерирование
восстановительных эквивалентов в виде
НАДФН для восстановительных реакций
биосинтеза. Ферменты, которые катализируют
реакции восстановления, часто используют
в качестве кофактора НАДФ+/НАДФН,
а окислительные ферменты – НАД+/НАДН.
Восстановительные реакции биосинтеза
жирных кислот и стероидных гормонов
требуют НАДФН, поэтому клетки печени,
жировой ткани и др., где протекает синтез
липидов, имеют высокий уровень ферментов
ПФП. В печени около 30% глюкозы подвергаются
превращениям в
ПФП.
НАДФН
используется при обезвреживании лекарств
и чужеродных веществ в монооксигеназной
цепи окисления в печени.
НАДФН
предохраняет ненасыщенные жирные
кислоты эритроцитарной мембраны от
аномальных взаимодействий с активным
кислородом. Кроме того, эритроциты
используют реакции ПФП для генерирования
больших количеств НАДФН, который
необходим для восстановления глутатиона,
участвующего в системе обезвреживания
активного кислорода, что позволяет
поддерживать нормальную степень
окисления Fe2+ в
гемоглобине.
Снабжение
клеток рибозо-5-фосфатом для синтеза
нуклеотидов, нуклеотидных коферментов
и нуклеиновых кислот. Превращение
рибонуклеотидов в дезоксирибонуклеотиды
также требует НАДФН, поэтому многие
быстро пролиферирующие клетки требуют
больших количеств НАДФН.
Хотя
это не значительная функция ПФП, он
принимает участие в метаболизме пищевых
пентоз, входящих в состав нуклеиновых
кислот пищи и может превращать их
углеродный скелет в интермедиаты
гликолиза и глюконеогенеза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
В мышцах основным акцептором лишнего
аминного азота является пируват.
При катаболизме белков в мышцах происходят
реакции трансаминирования аминокислот,
образуется глутамат, который далее
передает аминоазот на пируват и
образуется аланин.
Из мышц с кровью аланин переносится
в печень,
где в обратной реакции передает свою
аминогруппу на глутамат. Образующийся
пируват используется как субстрат в
реакциях синтеза глюкозы (глюконеогенез),
а глутаминовая кислота дезаминируется и
аммиак используется в синтезе мочевины.
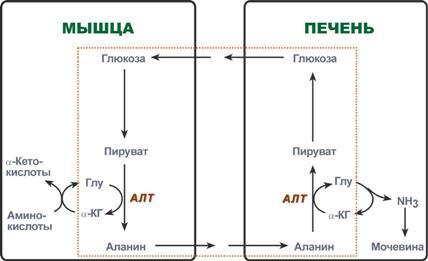
Реакции глюкозо-аланинового цикла (выделен рамкой).
Реакции,
связанные с транспортными формами
аммиака
Целевыми
органами для
транспорта аммиака
являются печень, почки и кишечник.
В печени:
аспарагин
и глутамин дезаминируются соответственно
аспарагиназой и глутаминазой, образующийся
аммиак используется для синтеза мочевины ,аланин
вступает в реакции трансаминирования с
α-кетоглутаратом,глутаминовая
кислота подвергается окислительному
дезаминированию.
В кишечнике часть
глутамина дезаминируется глутаминазой.
После этого образованный аммиак
выделяется в просвет кишечника (не
более 5%) или через кровь воротной
вены уходит в печень,
а глутамат вступает в трансаминирование
с пируватом, в результате чего аминоазот
переходит на аланин и с ним также
поступает в печень,
В почках идет образование аммонийных
солей с
использованием глутамата, глутамина и
аспарагина.
Накопление аммиака представляет проблему
Аммиак
является токсичным соединением,
находящимся в крови в относительно
небольших концентрациях (11,0-32,0 мкмоль/л).
Симптомы аммиачного отравления
проявляются при превышении этих пределов
всего в 2-3 раза. Предельно допустимый
уровень аммиака в крови 60 мкмоль/л. При
повышении концентрации аммиака
(гипераммониемия)
до предельных величин может наступить
кома и смерть. При хронической
гипераммониемии развивается умственная
отсталость.
Гипотезы токсичности аммиака
Токсичность
аммиака обусловлена следующими
обстоятельствами:
1.
Связывание аммиака при синтезе
глутамата вызывает отток
α-кетоглутарата из цикла
трикарбоновых кислот,
при этом понижается образование энергии
АТФ и ухудшается деятельность клеток.
2.
Ионы аммония NH4+ вызывают защелачивание плазмы
крови. При этом повышается сродство
гемоглобина к кислороду (эффект
Бора),
гемоглобин не отдает кислород в
капиллярах, в результате наступает
гипоксия клеток.
3.
Накопление свободного иона
NH4+ в
цитозоле влияет на мембранный потенциал
и работу внутриклеточных ферментов –
он конкурирует с ионными насосами для
Na+ и
K+.
4.
Продукт связывания аммиака с глутаминовой
кислотой – глутамин
– является
осмотически активным веществом. Это
приводит к задержке воды в клетках и их
набуханию, что вызывает отек тканей. В
случае нервной ткани это может вызвать
отек мозга, кому и смерть.
5.
Использование α-кетоглутарата и глутамата
для нейтрализации аммиака
вызывает снижение
синтеза γ-аминомасляной
кислоты (ГАМК),
тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий Приобретенные формы
Приобретенная
(вторичные) гипераммониемия развивается
вследствие заболеваний
печени и вирусных
инфекций.
В крайне тяжелых случаях она проявляется
как тошнота, рвота, судороги,
нечленораздельная речь, затуманивание
зрения, тремор, нарушение координации
движений.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
