Цикл кори в печени
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
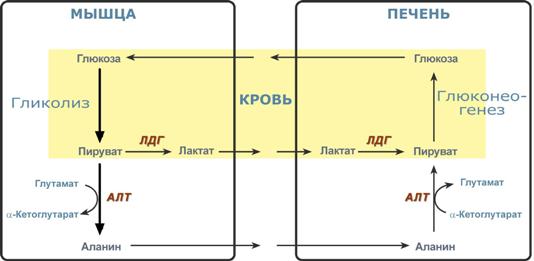
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
Цикл Кори (также известный как цикл молочной кислоты ), названный в честь его первооткрывателей, Карла Фердинанда Кори и Герти Кори , представляет собой метаболический путь, по которому лактат, вырабатываемый анаэробным гликолизом в мышцах, транспортируется в печень и превращается в глюкозу, которая затем возвращается в мышцы и циклически метаболизируется обратно в лактат.
Процесс
Для мышечной деятельности необходим АТФ , который обеспечивается расщеплением гликогена в скелетных мышцах . Распад гликогена, известный как гликогенолиз , высвобождает глюкозу в форме глюкозо-1-фосфата (G1P). G1P преобразуются в G6P по фосфоглюкомутазам . G6P легко участвует в гликолизе (или может перейти в пентозофосфатный путь, если концентрация G6P высока), процесс, который обеспечивает АТФ мышечным клеткам в качестве источника энергии. Во время мышечной активности необходимо постоянно пополнять запасы АТФ. Когда поступления кислорода достаточно, эта энергия поступает от подачи пирувата , одного из продуктов гликолиза, в цикл лимонной кислоты , который в конечном итоге генерирует АТФ посредством кислородзависимого окислительного фосфорилирования .
Когда поступление кислорода недостаточно, как правило, во время интенсивной мышечной активности, энергия должна высвобождаться за счет анаэробного метаболизма . Молочнокислая ферментация превращает пируват в лактат под действием лактатдегидрогеназы . Самое главное, ферментация восстанавливает НАД + , поддерживая его концентрацию, поэтому могут происходить дополнительные реакции гликолиза. На стадии ферментации НАДН, образующийся в результате гликолиза, окисляется обратно до НАД + , передавая два электрона от НАДН для восстановления пирувата до лактата. ( За подробностями обращайтесь к основным статьям по гликолизу и ферментации .)
Вместо того, чтобы накапливаться в мышечных клетках, лактат, вырабатываемый анаэробной ферментацией, поглощается печенью . Это инициирует вторую половину цикла Кори. В печени происходит глюконеогенез . С интуитивной точки зрения глюконеогенез обращает вспять как гликолиз, так и ферментацию, превращая лактат сначала в пируват, а затем обратно в глюкозу. Затем глюкоза поступает в мышцы через кровоток ; он готов к дальнейшим реакциям гликолиза. Если мышечная активность прекратилась, глюкоза используется для пополнения запасов гликогена за счет гликогенеза .
В целом, этапы гликолиза в цикле производят 2 молекулы АТФ за счет 6 молекул АТФ, потребляемых на этапах глюконеогенеза. Каждая итерация цикла должна поддерживаться чистым потреблением 4 молекул АТФ. В результате цикл не может продолжаться бесконечно. Интенсивное потребление молекул АТФ в цикле Кори переносит метаболическую нагрузку с мышц на печень.
Значение
Важность цикла основана на предотвращении лактоацидоза при анаэробных условиях в мышцах. Однако обычно до того, как это произойдет, молочная кислота перемещается из мышц в печень.
Кроме того, этот цикл важен для производства АТФ, источника энергии, во время мышечной нагрузки. Окончание мышечной нагрузки позволяет циклу Кори работать более эффективно. Это погашает кислородный долг, поэтому и цепь переноса электронов, и цикл лимонной кислоты могут производить энергию с оптимальной эффективностью.
Цикл Кори является гораздо более важным источником субстрата для глюконеогенеза, чем пища. Вклад лактата цикла Кори в общую выработку глюкозы увеличивается с увеличением продолжительности голодания до выхода на плато. В частности, после 12, 20 и 40 часов голодания добровольцев-людей на глюконеогенез приходится 41%, 71% и 92% продукции глюкозы, но вклад лактата цикла Кори в глюконеогенез составляет 18%, 35% и 36%. % соответственно. Оставшееся производство глюкозы происходит за счет распада белка, мышечного гликогена и глицерина в результате липолиза .
Препарат метформин может вызывать лактоацидоз у пациентов с почечной недостаточностью, поскольку метформин ингибирует печеночный глюконеогенез цикла Кори, особенно комплекс 1 дыхательной цепи митохондрий. Накопление лактата и его субстратов для производства лактата, пирувата и аланина, приводит к избытку лактата. . Обычно избыток лактата выводится почками, но у пациентов с почечной недостаточностью почки не могут справиться с избытком молочной кислоты.
Смотрите также
- Аланин цикл
- Цикл лимонной кислоты
Ссылки
- ^ “Карл и Герти Кори и углеводный метаболизм” . Американское химическое общество . 2004 . Дата обращения 12 мая 2020 .
- Перейти ↑ Nelson, David L., & Cox, Michael M. (2005) Lehninger Principles of Biochemistry Fourth Edition . Нью-Йорк: WH Freeman and Company, p. 543.
- ^ a b c « Цикл Кори, архивированный 23 апреля 2008 г. в Wayback Machine ». Получено 3 мая 2008 г. из Элмхерста, стр. 1–3.
- ^ Gerich JE, Майер С, Woerle HJ, Stumvoll М (2001). «Почечный глюконеогенез: его значение в гомеостазе глюкозы человека» . Уход за диабетом . 24 (2): 382–391. DOI : 10.2337 / diacare.24.2.382 . PMID 11213896 .
- ^ Nuttall FQ, Нго A, Ганнон MC (2008). “Регулирование производства глюкозы в печени и роль глюконеогенеза у человека: постоянна ли скорость глюконеогенеза?” . Исследования и обзоры диабета / метаболизма . 24 (6): 438–458. DOI : 10.1002 / dmrr.863 . PMID 18561209 . S2CID 24330397 .
- ^ a b c d Кац Дж, Тайек Дж. А. (1998). «Глюконеогенез и цикл Кори у людей, голодавших 12, 20 и 40 часов» . Американский журнал физиологии . 275 (3, часть 1): E537 – E542. DOI : 10.1152 / ajpendo.1998.275.3.E537 . PMID 9725823 .
- Перейти ↑ Cahill GF (2006). «Топливный обмен при голодании» (PDF) . Ежегодный обзор питания . 26 : 1–22. DOI : 10.1146 / annurev.nutr.26.061505.111258 . PMID 16848698 .
- ^ Vecchio, S. et al. «Накопление метформина: лактоацидоз и высокие уровни метформина в плазме в серии ретроспективных наблюдений у 66 пациентов, получающих хроническую терапию», Clin Toxicol. 2014; 52 (2).
- ^ Sirtori CR, Pasik C. “Повторная оценка бигуанида, метформина: механизм действия и переносимость”. Pharmacol Res 1994; 30.
Источники
- Смит, А. Д., Датта, С. П., Смит, Г. Ховард, Кэмпбелл, П. Н., Бентли, Р., (редакторы) и др. (1997) Оксфордский словарь биохимии и молекулярной биологии . Нью-Йорк: Издательство Оксфордского университета.
Источник
Лактат – конечный продукт анаэробного окисления глюкозы в мышцах, особенно в белых мышечных волокнах, где митохондрий меньше, чем в красных. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции. При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори.
Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Лактат, образовавшийся в мышцах, переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая с током крови может возвращаться в работающую мышцу. В печени часть лактата может окисляться до углекислого газа и воды, превращаться в пируват и вовлекаться в общий путь катаболизма.
Значение цикла Кори:
1. Регуляция постоянного уровня глюкозы в крови.
2. Обеспечивает утилизацию лактата.
3. Предотвращает накопление лактата (снижение рН – лактоацидоз).
4. Экономичное использование углеводов организмом.
Регуляция обмена углеводов осуществляется на уровне тканей – кровь, печень, мышцы.
Глюкогенные аминокислоты, к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину, который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл, подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин – глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол – продукт гидролиза липидов в жировой ткани.Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат – промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ);
б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ);
в) обращение первого субстратного фосфорилирования – образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).
Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6) используются 2 молекулы пирувата (С3). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет – 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.
Источник
Хотя в пределах конкретной ткани, например печени, преобладает движение углеродных атомов в направлении либо гликолиза, либо глюконеогенеза, в организме в целом гликолиз и глюконеогенез протекают, как правило, одновременно в разных тканях. Печень обнаруживает глюконеогенную активность, начиная примерно через 3 ч после приема содержащей углеводы пищи и сохраняя эту активность до следующего приема пищи. С другой стороны, форменные элементы крови, покоящаяся мышца и гораздо в большей степени работающая мышца непрерывно продуцируют лактат. Сочетанная активность глюконеогенеза и гликолиза, обусловливающая кругооборот углеродных скелетов глюкозы и лактата между печенью и мышцей, известна под названием цикла Кори (рис. 10—5). Глюкоза высвобождается печенью в кровоток и поглощается мышечной тканью. В мышце глюкоза подвергается гликолизу и ее углеродный скелет высвобождается в кровь в виде лактата и пирувата. Печень экстрагирует лактат и пируват из крови и в ходе глюконеогенеза вновь превращает эти субстраты в глюкозу. Подсчитано, что повторный кругооборот углеродных скелетов между лактатом и глюкозой составляет 20% от общего кругооборота каждого из этих субстратов.
Цикл Кори не может привести к образованию новых молекул глюкозы. Однако он является механизмом, с помощью которого конечные продукты гликолиза могут вступать на путь анаболизма, а не накапливаться в крови или подвергаться дальнейшему окислению. Описан также аналогичный цикл между глюкозой и аланином (глюкозоаланиновый цикл) [10], который будет проанализирован в разделе, посвященном метаболизму аминокислот.
Несмотря на быстрый кругооборот глюкозы через цикл Кори, уровень лактата и пирувата в крови в норме не достигает 1 мМ. Однако в условиях повышенного анаэробного гликолиза, будь то вследствие физиологических (например, физическая работа) или патологических (сосудистый коллапс при гиповолемии, сепсисе или кардиогенном шоке) стимулов, происходит накопление лактата. Лактат накапливается и при нарушении цикла Кори под влиянием угнетающих глюконеогенез веществ, таких, как этанол или фруктоза. Антиглюконеогенный эффект этанола обусловлен значительным увеличением отношения НАД-Н/НАД вследствие метаболизма спирта под действием фермента алкогольдегидрогеназы. В результате накопления избыточного количества НАД•Н ингибируется превращение лактата в пируват. Более того, пируват, образующийся при дезаминировании аланина, также быстро превращается в лактат. В отличие от этого глюконеогенез из глицерина, вступающий на этот путь на уровне триозофосфатов (см. рис. 10—4), этанолом не ингибируется.
Рис.10—5. Цикл Кори (лактат ® глюкоза) и глюкозоаланиновый цикл. В обоих циклах глюкоза поглощается мышцей и превращается в пируват и лактат. Часть пирувата в мышце подвергается аминированию с образованием аланина. Образующиеся из глюкозы лактат и аланин в печени вновь превращаются в глюкозу.
Глюконеогенез — не единственный путь метаболизма для лактата, высвобождаемого в кровоток. В печени и гораздо в большей степени в сердечной мышце и почках лактат подвергается окончательному окислению в СО2.
Источник
РАЗДЕЛ 7. ОБМЕН УГЛЕВОДОВ
IX. Ситез глюкозы в печени (глюконеогенез)
Некоторые ткани, например, мозг, нуждаются в постоянном поступлении глюкозы. Когда поступление углеводов в составе пищи недостаточно, содержание глюкозы в крови некоторое время поддерживается в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6 —10 ч голодания и практически полностью исчерпываются после суточного голодания. В этом случае в печени начинается синтез глюкозы de novo — глюконеогенез.Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80 — 100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот (см. раздел 8).
Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например, эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др.
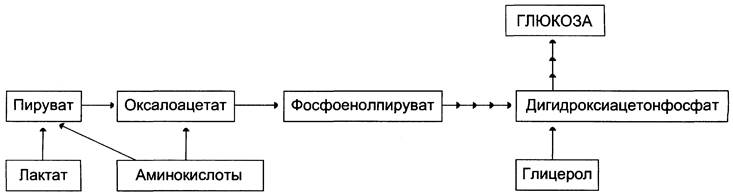
Первичные субстраты глюконеогенеза — лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
• Лактат — продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
• Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
• Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
На рисунке 7-44 показаны пункты включения первичных субстратов в глюконеогенез.
Рис. 7-44. Включение субстратов в глюконеогенез.
А. Реакции глюконеогенеза
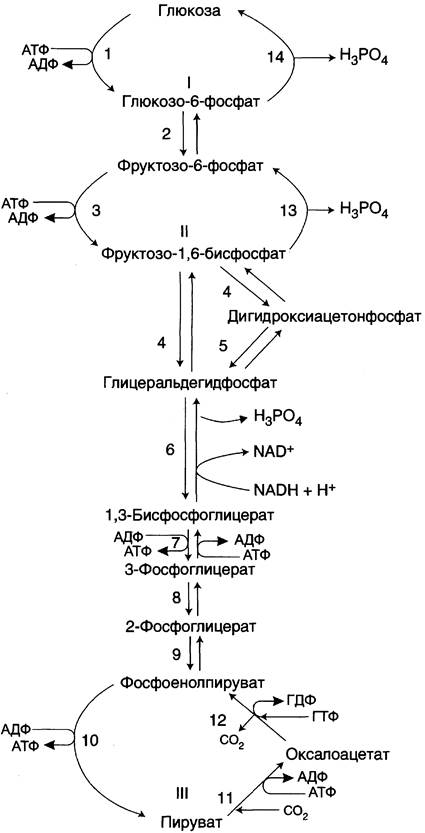
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза (рис. 7-45, реакции 9, 8, 7, 6, 5, 4, 2) и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями.
Рис. 7-45. Гликолиз и глюконеогенез. Ферменты обратимых реакций гликолиза и глюконеогенеза: 2 — фосфоглюкоизомераза; 4 — альдолаза; 5 — триозофосфатизомераза; 6 — глицеральдегидфосфатдегидрогеназа; 7 — фосфоглицераткиназа; 8 — фосфоглицератмутаза; 9 — енолаза. Ферменты необратимых реакций глюконеогенеза: 11 — пируваткарбоксилаза; 12 — фосфоенолпируваткарбоксикиназа; 13 — фруктозо- 1,6-бисфосфатаза; 14 — глюкозо-6-фосфатаза. I-III —субстратные циклы.
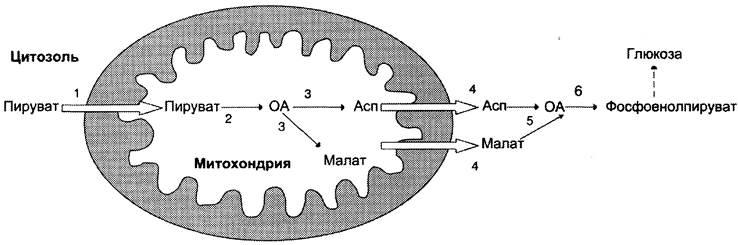
Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
Рассмотрим более подробно те реакции глюконеогенеза, которые отличаются от реакций гликолиза и происходят в глюконеогенезе с использованием других ферментов. Рассмотрим процесс синтеза глюкозы из пирувата.
1. Образование фосфоенолпирувата из пирувата — первая из необратимых стадий глюконеогенеза
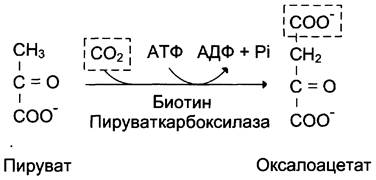
Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций (рис. 7-45, реакции 11, 12), первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата (рис. 7-46). Пируват- карбоксилаза,катализирующая данную реакцию, — митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Рис. 7-46. Образование оксалоацетата из пирувата.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата (рис. 7-47) при участии НАDН (обратная реакция цитратного цикла). Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма, рассмотренного ранее (рис. 7-39).
Рис. 7-47. Превращение оксалоацетата в малат.
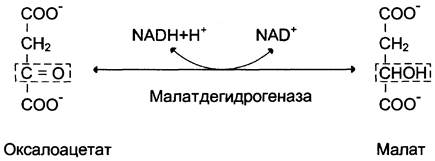
В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малата катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором — цитозольный. Образованный в цитозоле из малата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой — ГТФ-зависимым ферментом (рис. 7-48). Название фермента дано по обратной реакции.
Рис. 7-48. Превращение оксалоацетата в фосфоенолпируват.
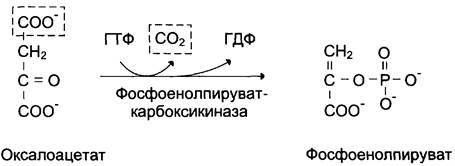
Схема всех реакций, протекающих на первой необратимой стадии глюконеогенеза, представлена на рис. 7-49.
Рис. 7-49. Образование оксалоацетата, транспорт в цитозоль и превращение в фосфоенолпируват. 1 — транспорт пирувата из цитозоля в митохондрию; 2 — превращение пирувата в оксалоацетат (ОА); 3 — превращение ОА в малат или аспартат; 4 — транспорт аспартата и маната из митохондрии в цитозоль; 5 — превращение аспартата и маната в ОА; 6 — превращение ОА в фосфоенолпируват.

Следует отметить, что этот обходной участок глюконеогенеза требует расхода двух молекул с макроэргическими связями (АТФ и ГТФ) в расчёте на одну молекулу исходного вещества — пирувата. В пересчёте на синтез одной молекулы глюкозы из двух молекул пирувата расход составляет 2 моль АТФ и 2 моль ГТФ или 4 моль АТФ (для удобства рассуждений предлагается считать, что энергозатраты на синтез АТФ и ГТФ равны). После образования фосфоенолпирувата все остальные реакции также
протекают в цитозоле вплоть до образования фруктозо-1,6-бисфосфата и катализируются гликолитическими ферментами.
2. Гидролиз фруктозо-1,6-бисфосфата и глюкозо-6-фосфата
Отщепление фосфатной группы из фруктозо-1,6-бисфосфата и глюкозо-6-фосфата — также необратимые реакции глюконеогенеза. В ходе гликолиза эти реакции катализируют специфические киназы с использованием энергии АТФ. В глюконеогенезе они протекают без участия АТФ и АДФ и ускоряются не киназами, а фосфатазами — ферментами, принадлежащими к классу гидролаз. Ферменты фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза катализируют отщепление фосфатной группы от фруктозо-1,6-бисфосфата и глюкозо-6-фосфата. После чего свободная глюкоза выходит из клетки в кровь. Схема всех реакций глюконеогенеза представлена на рис. 7-45.
Итак, в печени существуют 4 фермента, которые принимают участие только в глюконеогенезе и катализируют обходные реакции необратимых стадий гликолиза. Это — пируват- карбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-бисфосфатаза и глюкозо-6- фосфатаза.
3. Энергетический баланс глюконеогенеза из пирувата
В ходе этого процесса расходуются 6 моль АТФ на синтез 1 моль глюкозы из 2 моль пирувата. Четыре моль АТФ расходуются на стадии синтеза фосфоенолпирувата из оксалоацетата и ещё 2 моль АТФ на стадиях образования 1,3-бисфосфоглицерата из 3-фосфоглицерата.
Суммарный результат глюконеогенеза из пирувата выражается следующим уравнением:
2 Пируват + 4 АТФ + 2 ГТФ + 2 (NАDН + Н+) + 4 Н2O —> Глюкоза + 4 АДФ + 2 ГДФ + 6 Н3РO4 + 2 NАD+.
Б. Синтез глюкозы из лактата
Лактат, образованный в анаэробном гликолизе, не является конечным продуктом метаболизма. Использование лактата связано с его превращением в печени в пируват. Лактат как источник пирувата важен не столько при голодании, сколько при нормальной жизнедеятельности организма. Его превращение в пируват и дальнейшее использование последнего являются способом утилизации лактата.
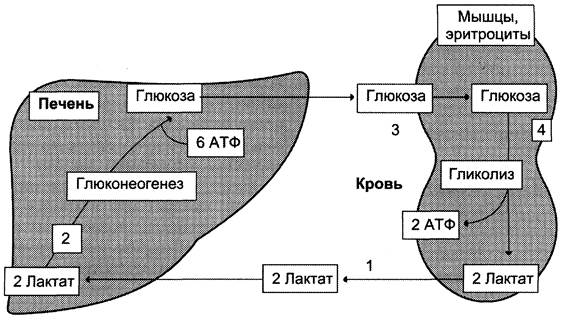
Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NАDН/NАD+ ниже, чем в сокращающейся мышце, поэтому лакгатдегидрогеназная реакция протекает в обратном направлении, т. е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту
последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори» (рис. 7-50). Цикл Кори выполняет 2 важнейшие функции: 1 — обеспечивает утилизацию лактата; 2 — предотвращает накопление лактата и, как следствие этого, опасное снижение pH (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СO2 и Н2O. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Рис. 7-50. Цикл Кори (глюкозо-лактатный цикл). 1 — поступление лактата из сокращающейся мышцы с током крови в печень; 2 — синтез глюкозы из лактата в печени; 3 — поступление глюкозы из печени с током крови в работающую мышцу; 4 — использование глюкозы как энергетического субстрата сокращающейся мышцей и образование лактата.
Лактоацидоз. Термин «ацидоз» обозначает увеличение кислотности среды организма (снижение pH) до значений, выходящих за пределы нормы. При ацидозе либо увеличивается продукция протонов, либо происходит снижение их экскреции (в некоторых случаях и то и другое). Метаболический ацидоз возникает при увеличении концентрации промежуточных продуктов обмена (кислотного характера) вследствие увеличения их синтеза или уменьшения скорости распада или выведения. При нарушении кислотно-основного состояния организма быстро включаются буферные системы компенсации (через 10 — 15 мин). Лёгочная компенсация обеспечивает стабилизацию соотношения НСO3-/Н2СO3, которая в норме соответствует 1:20, а при ацидозе уменьшается. Лёгочная компенсация достигается увеличением объёма вен
тиляции и, следовательно, ускорением выведения СO2 из организма. Однако основную роль в компенсации ацидоза играют почечные механизмы с участием аммиачного буфера (см. раздел 9). Одной из причин метаболического ацидоза может быть накопление молочной кислоты. В норме лактат в печени превращается обратно в глюкозу путём глюконеогенеза либо окисляется. Кроме печени, другим потребителем лактата служат почки и сердечная мышца, где лактат может окисляться до СO2 и Н2O и использоваться как источник энергии, особенно при физической работе.
Уровень лактата в крови — результат равновесия между процессами его образования и утилизации. Кратковременный компенсированный лактоацидоз встречается довольно часто даже у здоровых людей при интенсивной мышечной работе. У нетренированных людей лактоацидоз при физической работе возникает как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции.
При некомпенсированном лактоацидозе содержание лактата в крови увеличивается до 5 ммоль/л (в норме до 2 ммоль/л). При этом pH крови может составлять 7,25 и менее (в норме 7,36-7,44).
Повышение содержания лактата в крови может быть следствием нарушения метаболизма пирувата (рис. 7-51).
Рис. 7-51. Нарушения метаболизма пирувата при лактоацидозе. 1 — нарушение использования пирувата в глюконеогенезе; 2 — нарушение окисления пирувата.
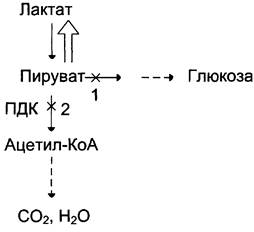
Так, при гипоксии, возникающей вследствие нарушения снабжения тканей кислородом или кровью, уменьшается активность пируватдегидрогеназного комплекса и снижается окислительное декарбоксилирование пирувата. В этих условиях равновесие реакции пируват <-> лактат сдвинуто в сторону образования лактата. Кроме того, при гипоксии уменьшается синтез АТФ, что, следовательно, ведёт к снижению скорости глюконеогенеза — другого пути утилизации лактата. Повышение концентрации лактата и снижение внутриклеточного pH отрицательно влияют на активность всех ферментов, в том числе и пируваткарбоксилазы, катализирующей начальную реакцию глюконеогенеза.
Возникновению лактоацидоза также способствуют нарушения глюконеогенеза при печёночной недостаточности различного происхождения. Кроме того, лактоацидозом может сопровождаться гиповитаминоз В1, так как производное этого витамина (тиаминдифосфат) выполняет коферментную функцию в составе ПДК при окислительном декарбоксилировании пирувата (см. раздел 6). Дефицит тиамина может возникать, например, у алкоголиков с нарушенным режимом питания.
Итак, причинами накопления молочной кислоты и развития лактоацидоза могут быть:
• активация анаэробного гликолиза вследствие тканевой гипоксии различного происхождения;
• поражения печени (токсические дистрофии, цирроз и др.);
• нарушение использования лактата вследствие наследственных дефектов ферментов глюконеогенеза, недостаточности глюкозо-6-фосфатазы;
• нарушение работы ПДК вследствие дефектов ферментов или гиповитаминозов;
• применение ряда лекарственных препаратов, например, бигуанидов (блокаторы глюконеогенеза, используемые при лечении сахарного диабета).
В. Синтез глюкозы из аминокислот
В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты нитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как нитратного цикла, так и глюконеогенеза.
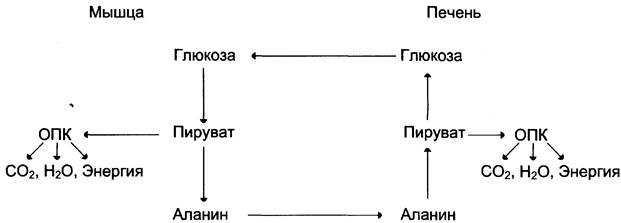
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюконеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах —> пируват в мышцах —> аланин в мышцах —> аланин в печени —> глюкоза в печени —> глюкоза в мышцах (рис. 7-52). Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Рис. 7-52. Глюкозо-аланиновый цикл.
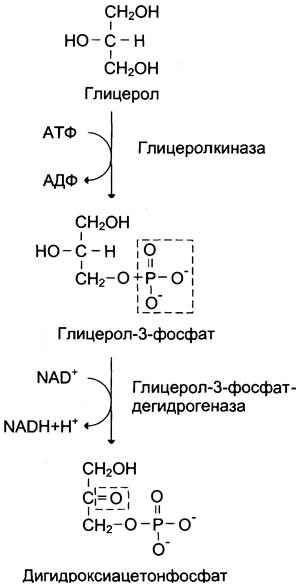
Г. Синтез глюкозы из глицерола
Глицерол образуется при гидролизе триацил- глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например, печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зaвисимой дегидрогеназой с образованием дигидроксиацетонфосфата (рис. 7-53), который далее превращается в глюкозу.
Рис. 7-53. Превращение глицерола в дигидроксиацетон- фосфат.
Источник
