Цикл кори биологическая роль
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
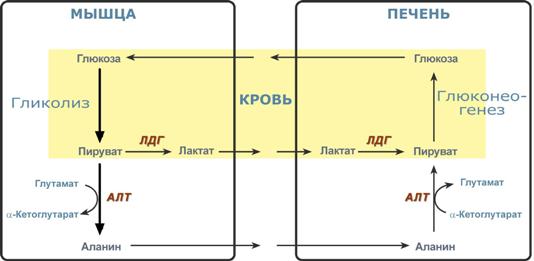
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
Лактат – конечный продукт анаэробного окисления глюкозы в мышцах, особенно в белых мышечных волокнах, где митохондрий меньше, чем в красных. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции. При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори.
Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Лактат, образовавшийся в мышцах, переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая с током крови может возвращаться в работающую мышцу. В печени часть лактата может окисляться до углекислого газа и воды, превращаться в пируват и вовлекаться в общий путь катаболизма.
Значение цикла Кори:
1. Регуляция постоянного уровня глюкозы в крови.
2. Обеспечивает утилизацию лактата.
3. Предотвращает накопление лактата (снижение рН – лактоацидоз).
4. Экономичное использование углеводов организмом.
Регуляция обмена углеводов осуществляется на уровне тканей – кровь, печень, мышцы.
Глюкогенные аминокислоты, к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину, который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл, подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин – глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол – продукт гидролиза липидов в жировой ткани.Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат – промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ);
б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ);
в) обращение первого субстратного фосфорилирования – образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).
Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6) используются 2 молекулы пирувата (С3). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет – 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.
Источник
56 Глюконеогенез. Цикл Корі
Глюконеогенез – синтез глюкози з невуглеводних продуктів. Такими продуктами або метаболітами є в першу чергу молочна й пировиноградна кислоти, так звані глікогенні амінокислоти, гліцерол і ряд інших з’єднань. Іншими словами, попередниками глюкози в глюконеогенезі може бути пируват або будь-яка сполука, що перетворюється в процесі катаболізму в пируват або один із проміжних продуктів циклу трикарбонових кислот.
У хребетних найбільше інтенсивно глюконеогенез протікає в клітинах печінки й нирок (у корковій речовині).
Більшість стадій глюконеогенезу являє собою обіг реакції гліколізу. Тільки 3 реакції гліколізу (гексокиназна, фосфо-фруктокіназна й пируваткіназна) необоротні, тому в процес глюконеогенезу на 3 етапах використаються др ферменти.
Більшість реакцій гліколізу, як було показано вище, є оберненими. При глюкогенезі вони ідуть у оберненому напрямі. Однак реакції гліколізу, які є незворотними, оскільки супроводжуються великими змінами вільної енергії, при глюкогенезі заміняються іншими, обхідними. Таких обхідних реакцій при глюкогенезі є три. Перша – це синтез фосфоенолпірувату із пірувату. Вона відбувається з утворенням проміжного продукту – оксалоацетату шляхом карбоксилювання пірувату та його наступного фосфорилювання і декарбоксилювання з утворенням фосфоенолпірувату:
Розглянемо шлях синтезу глюкози з пирувата. Утворення фосфоенолпирувату з пирувату. Синтез фосфоенолпирувату здійснюється в кілька етапів. Спочатку пируват під впливом пируваткарбоксилази й при участі СО2 і АТФ карбоксилюється з утворенням оксалоацетату:
Потім оксалоацетат у результаті декарбоксилювання й фосфорилювання під впливом ферменту фосфоенолпируваткарбоксилази перетворюється у фосфоенолпируват. Донором фосфатного залишку в реакції служить гуанозинтрифосфат (ГТФ):
Установлено, що в процесі утворення фосфоенолпирувата беруть участь ферменти цитозоля й мітохондрій.
Перший етап синтезу протікає в мітохондріях Пируват-карбоксилаза, що каталізує цю реакцію, є аллостеричним мітохондріальним ферментом. У якості аллостеричного активатору даного ферменту необхідний ацетил-Коа. Мембрана мітохондрій непроникна для що новоутвореного оксалоацетату. Останній тут же, у мітохондріях, відновлюється в малат:
COOH COOH
│ │
CH2 CH2
│ + НАДН+Н_______ │ + НАД+
C=O HCOH
│ │
COOH COOH
Малатдегідрогеназа
мітохондріальна
Реакція протікає при участі митохондріальной НАД залежної малатдегідрогенази. У мітохондріях відношення НАДН/НАД+ відносно велике, у зв’язку із чим внутрішньомітохондріальний оксалоацетат легко відновлюється в малат, що легко виходить із мітохондрії через митохондріальну мембрану. У цитозолі відношення НАДН/НАД+ дуже мало, і малат знову окисляється при участі цитоплазматичної НАД-залежної малатдегідрогенази:
COOH COOH
│ │
CH2 CH2
│ + НАД+————— │ + НАДH+H
CHOH C=O
│ │
COOH COOH
Малатдегідрогеназа
(цитоплазматична)
Подальше перетворення оксалоацетата у фосфоенолпируват відбувається в цитозолі клітини.
Перетворення фруктозо-1,6-бісфосфату у фруктозо-6-фосфат. Фосфо-енолпируват, що утворився з пируват, у результаті ряду оборотних реакцій гліколізу перетворюється у фруктозо-1,6-бисфосфат. Далі треба фосфофруктокіназна реакція, що необоротня. Глюконеогенез іде в обхід цієї ендергонічної реакції. Перетворення фруктозо-1,6-біфосфату у фруктозо-6-фосфат каталізується специфічною фосфатазою
Утворення глюкози із глюкозо-6-фосфата. У наступній оборотній стадії біосинтезу глюкози фруктозо-6-фосфат перетворюється в глюкозо-6-фосфат. Останній може дефосфорилюватися (тобто реакція йде в обхід гексокиназной реакції) під впливом ферменту глюкозо-6-фосфатази
Загальна схема глюкогенезу
Існує взаємозв’язок між депо вуглеводів (печінкою) і працюючими органами (м’язами) в забезпеченні повторного використання ресурсів. При посиленому розпаді глікогену під час роботи в м’язах в кров виділяється молочна кислота. З током крові вона попадає в клітини печінки. Там з неї шляхом глюкогенезу синтезуються глюкоза і глікоген. При потребі глікоген печінки розпадається до глюкози, яка виходить в кров, транспортується в м’язи і забезпечує там ресинтез глікогену для виконання нового навантаження. В клітинах м’язів реакції глюкогенезу не відбуваються. Описаний процес називається циклом Корі:
Утворення глюкози із глюкозо-6-фосфата. У наступній оборотній стадії біосинтезу глюкози фруктозо-6-фосфат перетворюється в глюкозо-6-фосфат. Останній може дефосфорилюватися (тобто реакція йде в обхід гексокиназной реакції) під впливом ферменту глюкозо-6-фосфатази:
Цикл Корі
57.Регуляція глюконеогенеза.
Важливим моментом у регуляції глюконеогенезу є реакція, яка каталізується пируваткарбоксилазой. Роль позитивного алостеричного модулятору цього ферменту виконує ацетил-Коа. Під час відсутності ацетил-Коа фермент майже повністю позбавлений активності. Коли в клітині накопичується митохондріальний ацетил-Коа, біосинтез глюкози з пирувату активується . Відомо, що ацетил-Коа одночасно є негативним модулятором пируватдегідрогеназного комплексу Отже, нагромадження ацетил-Коа сповільнює окисне декарбоксилювання пирувата, що також сприяє перетворенню останнього в глюкозу.
Інший важливий момент у регуляції глюконеогенезу – реакція, яка каталізується фруктозо-1,6-бисфосфатазою – ферментом, що інгібірується АМФ. Протилежна дія АМФ робить на фосфофруктокіназу, тобто для цього ферменту він є алостеричним активатором. При низькій концентрації АМФ і високому рівні АТФ відбувається стимуляція глюконеогенезу. Навпроти, коли величина відношення АТФ/АМФ невелика, у клітині спостерігається розщеплення глюкози.
В 1980 р. групою бельгійських дослідників (Г. Херс і ін.) у тканині печінки був відкритий фруктозо-2,6-бисфосфат, що є потужним регулятором активності двох перерахованих ферментів:
Фруктозо-2,6-бисфосфат активує фосфофруктокіназу й інгибірує фруктозо-1,6-бісфосфатазу. Підвищення в клітині рівня фруктозо-2,6-біса-фосфату сприяє посиленню гліколізу й зменшенню швидкості глюконеогенезу. При зниженні концентрації фруктозо-2,6-бисфосфата відзначається зворотна картина.
Установлено, що біосинтез фруктозо-2,6-бисфосфата походить із фруктозо-6-фосфата при участі АТФ, а розпадається ОН на фруктозо-6-фосфат і неорганічний фосфат. Біосинтез і розпад фруктозо-2,6-біфосфату каталізується тим самим ферментом, тобто даний фермент біфункціональний, він має й фосфокіназною, і фосфатазною активністю:
Показано також, що біфункціональний фермент у свою чергу регулюється шляхом цАМФ-залежного фосфорилювання. Фосфорилювання приводить до збільшення фосфатазной активності й зниженню фосфо-кіназної активності біфункционального ферменту. Цей механізм пояснює швидкий вплив гормонів, зокрема глюкагона, на рівень фруктозо-2,6-бисфосфата в клітині
Активність біфункціонального ферменту регулюється також деякими метаболітами, серед яких найбільше значення має гліцерол-3-фосфат. Дія гліцерол-3-фосфата на фермент по своїй спрямованості аналогічна ефекту, що спостерігається при його фосфорилюванні за допомогою цАМФ-залежить протеїнкіназ.
У цей час фруктозо-2,6-бисфосфат, крім печінки, виявлений і в інших органах і тканинах тварин, а також у рослин і мікроорганізмів.
Показано, що глюконеогенез може регулюватися й непрямим шляхом, тобто через зміну активності ферменту, що безпосередньо не участвують у синтезі глюкози. Так, установлено, що фермент гліколізу пируваткіназа існує в 2 формах – L і М. Форма L (від англ. lіver – печінка) переважає в тканинах, здатних до глюконеогенезу. Ця форма інгібі-руєтсья надлишком АТФ і деякими амінокислотами, зокрема аланіном. М-форма (від англ. muscle – м’яза) такої регуляції не піддана. В умовах достатнього забезпечення клітини енергією відбувається інгибірування L-форми пируваткинази. Як наслідок інгибірування вповільнюється гліколіз і створюються умови, які сприяють глюконеоге-незу.
Нарешті, цікаво відзначити, що між гліколізом, що інтенсивно протікає в м’язовій тканині при її активній діяльності, і глюконеогенезом, особливо характерним для печіночної тканини, існує тісний взаємозв’язок. При максимальній активності м’язів у результаті посилення гліколізу утвориться надлишок молочної кислоти, що дифундує в кров, у печінці значна її частина перетворюється в глюкозу (глюконеогенез). Така глюкоза потім може бути використана як енергетичний субстрат, необхідний для діяльності м’язової тканини.
Источник
Глюконеогенез
– это образование глюкозы вновь
из неуглеводных компонентов: пирувата,
лактата,гликогенных аминокислот,
глицерина,любого соединения, которое
в процессе катаболизма может быть
превращено в пируват или один из
метаболитов цикла Кребса.
Глюконеогенез
протекает в: печени, корковом веществе
почек,слизистой кишечника.За счёт
глюконеогенеза в условиях углеводного
голодания образуется 80 г глюкозы.
Глюконеогенез–это
частично обращённый гликолиз.
Три
реакции гликолиза необратимы, поэтому
используются другие ферменты.
Пируваткиназная реакция заменяется
двумя:пируваткарбоксилазной реакцией
и фосфоенолпируваткарбоксикиназной
реакцией.
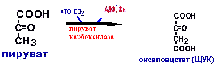

Между
этими реакциями существует челночный
механизм.ЩУК не может самостоятельно
выйти из митохондрий.ЩУК + НАДН+Н =
малат + НАД. В цитоплазме малат окисляется
цитоплазматической малатдегидрогеназой
до ЩУК

От
ФЕП до ФФК реакции все реакции идут в
обратной последовательности
гликолиза:Фосфофруктокиназная реакция
заменяется фруктозодифосфатазной
реакцией.
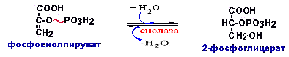
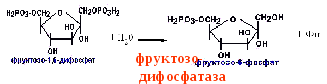
Биологическая
роль глюконеогенезаизбавление от
лактата (85% лактата идёт на глюконеогенез,
15% – окисляется до СО2, Н2О и энергии),
связь обменов, получение эндогенной
глюкозы.
Итоговое
уравнение глюконеогенеза
2
лактата + 6АТФ + 4Н2О + 2НАДН+Н глюкоза
+ 6АДФ + 6Фн + 2НАД
АТФ
используется в пируваткарбоксилазной,
фосфоенолпируваткарбоксикиназной,
фосфоглицераткиназной реакциях. НАДН+Н
необходим для ГАФДГ. 2Н20 участвуют в
енолазной реакции. 2Н20 – в фосфатазных
реакциях.
Регуляция
глюконеогенеза4 фермента определяют
скорость процесса. При уменьшении АТФ
и НАД тормозится глюконеогенез. Ключевые
ферменты стимулируются АТФ,ингибируются
– АДФ и АМФ. Инсулин – репрессор ферментов
глюконеогенеза.Процесс активируется:
глюкокортикоидами, жирными кислотами,
избытком лактата в крови, глюкагоном.
Цикл
Кори
осуществляет связь между
гликолизом в мышце при активной работе
и глюконеогенезом в печени. При работе
лактат поступает из мышц в кровь и
печень.

Мышца
Кровь
Печень
3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
МБ+КФК
ЛДГ
АСТ/АЛТ
Миоглобин
тропонин
Билет
23
1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
Холестерин:
циклический
ненасыщенный спирт,нерастворим
в воде,в
основе холестерина лежит кольцо
циклопентанпергидрофенантрена.
Содержится
в: коре надпочечников, мозге, нервной
ткани, мышцах, соединительной ткани,
жировой ткани.
Биороль:
синтез
желчных кислот,синтез
половых гормонов,синтез
кортикостероидов,синтез
витамина D3,входит
в состав клеточных мембран, миелиновых
оболочек,участвует
в образовании желчных камней, развитии
атеросклероза.
Пищевые
источники холестерина:
печень,
яйца,
мясо,
мозг,
икра.
Синтезируется
в:
эндоплазматическом
ретикулуме, цитозоле печени (80%),
коже,
стенке
тонкой кишки.
Синтез
холестерина:
включает
35 реакций,идёт
в 3 стадии:
образование
из ацетил-КоА мевалоновой кислоты,образование
из мевалоновой кислоты сквалена,циклизация
сквалена в холестерин.
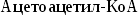

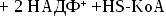
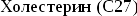
Холестеринемии:
1)Наследственная.
В
сыворотке крови увеличено содержание
холестерина, β-липопротеинов
Механизм
развития заболевания– отсутствие
или снижение количества рецепторов
клеток к ЛПНП, снижается захват и
катаболизм холестерина из ЛПНП,
увеличивается содержание холестерина
в плазме, оседание холестерина на стенки
сосудов, развитие атеросклеротических
бляшекОсложнения– ранний инфаркт миокарда, ксантоматоз,
инсульт
2)
Алиментарная гиперхолестеринемиявозникает от избытка в питании холестерина
3)Вторичная
гиперхолестеринемиявозникает
при гипотиреозе, сахарном диабете,
подагре, нефротическом синдроме
Атеросклероз:
Заболевание,
связанное с накоплением холестерина
в интиме сосудов с последующей
дегенерацией, отложением в очаг поражения
солей кальция, фиброзированием очага
и тромбозомДиагностические
критерии:гиперлипидемия,
гиперхолестеринемия
изменение
состава и соотношения транспортных
форм холестерина (увеличение ЛПНП и
уменьшение ЛПНП)Снижение
соотношения фосфолипиды
холестерин
Снижение
активности липопротеинлипазыУменьшение
в составе триацилглицеринов
полиненасыщенных жирных кислот и эфиров
холестерина
Способствуют
развитию атеросклероза:
наследственная
предрасположенность
гипертония
сахарный
диабет
ожирение
стрессы
гиподинамия
нарушение
равновесия свертывающей и противосвертывающей
системы крови.
Соседние файлы в предмете Биохимия
- #
- #
Источник
