Биологическая роль цикла кори
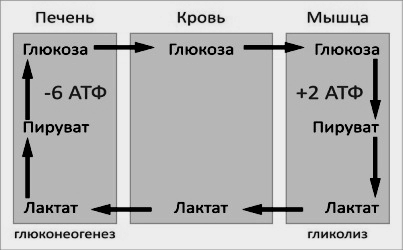
Лактат – конечный продукт анаэробного окисления глюкозы в мышцах, особенно в белых мышечных волокнах, где митохондрий меньше, чем в красных. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции. При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори.
Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Лактат, образовавшийся в мышцах, переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая с током крови может возвращаться в работающую мышцу. В печени часть лактата может окисляться до углекислого газа и воды, превращаться в пируват и вовлекаться в общий путь катаболизма.
Значение цикла Кори:
1. Регуляция постоянного уровня глюкозы в крови.
2. Обеспечивает утилизацию лактата.
3. Предотвращает накопление лактата (снижение рН – лактоацидоз).
4. Экономичное использование углеводов организмом.
Регуляция обмена углеводов осуществляется на уровне тканей – кровь, печень, мышцы.
Глюкогенные аминокислоты, к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину, который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл, подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин – глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол – продукт гидролиза липидов в жировой ткани.Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат – промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ);
б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ);
в) обращение первого субстратного фосфорилирования – образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).
Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6) используются 2 молекулы пирувата (С3). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет – 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.
Источник
Глюконеогенез
– это образование глюкозы вновь
из неуглеводных компонентов: пирувата,
лактата,гликогенных аминокислот,
глицерина,любого соединения, которое
в процессе катаболизма может быть
превращено в пируват или один из
метаболитов цикла Кребса.
Глюконеогенез
протекает в: печени, корковом веществе
почек,слизистой кишечника.За счёт
глюконеогенеза в условиях углеводного
голодания образуется 80 г глюкозы.
Глюконеогенез–это
частично обращённый гликолиз.
Три
реакции гликолиза необратимы, поэтому
используются другие ферменты.
Пируваткиназная реакция заменяется
двумя:пируваткарбоксилазной реакцией
и фосфоенолпируваткарбоксикиназной
реакцией.

Между
этими реакциями существует челночный
механизм.ЩУК не может самостоятельно
выйти из митохондрий.ЩУК + НАДН+Н =
малат + НАД. В цитоплазме малат окисляется
цитоплазматической малатдегидрогеназой
до ЩУК

От
ФЕП до ФФК реакции все реакции идут в
обратной последовательности
гликолиза:Фосфофруктокиназная реакция
заменяется фруктозодифосфатазной
реакцией.
Биологическая
роль глюконеогенезаизбавление от
лактата (85% лактата идёт на глюконеогенез,
15% – окисляется до СО2, Н2О и энергии),
связь обменов, получение эндогенной
глюкозы.
Итоговое
уравнение глюконеогенеза
2
лактата + 6АТФ + 4Н2О + 2НАДН+Н глюкоза
+ 6АДФ + 6Фн + 2НАД
АТФ
используется в пируваткарбоксилазной,
фосфоенолпируваткарбоксикиназной,
фосфоглицераткиназной реакциях. НАДН+Н
необходим для ГАФДГ. 2Н20 участвуют в
енолазной реакции. 2Н20 – в фосфатазных
реакциях.
Регуляция
глюконеогенеза4 фермента определяют
скорость процесса. При уменьшении АТФ
и НАД тормозится глюконеогенез. Ключевые
ферменты стимулируются АТФ,ингибируются
– АДФ и АМФ. Инсулин – репрессор ферментов
глюконеогенеза.Процесс активируется:
глюкокортикоидами, жирными кислотами,
избытком лактата в крови, глюкагоном.
Цикл
Кори
осуществляет связь между
гликолизом в мышце при активной работе
и глюконеогенезом в печени. При работе
лактат поступает из мышц в кровь и
печень.
Мышца
Кровь
Печень
3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
МБ+КФК
ЛДГ
АСТ/АЛТ
Миоглобин
тропонин
Билет
23
1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
Холестерин:
циклический
ненасыщенный спирт,нерастворим
в воде,в
основе холестерина лежит кольцо
циклопентанпергидрофенантрена.
Содержится
в: коре надпочечников, мозге, нервной
ткани, мышцах, соединительной ткани,
жировой ткани.
Биороль:
синтез
желчных кислот,синтез
половых гормонов,синтез
кортикостероидов,синтез
витамина D3,входит
в состав клеточных мембран, миелиновых
оболочек,участвует
в образовании желчных камней, развитии
атеросклероза.
Пищевые
источники холестерина:
печень,
яйца,
мясо,
мозг,
икра.
Синтезируется
в:
эндоплазматическом
ретикулуме, цитозоле печени (80%),
коже,
стенке
тонкой кишки.
Синтез
холестерина:
включает
35 реакций,идёт
в 3 стадии:
образование
из ацетил-КоА мевалоновой кислоты,образование
из мевалоновой кислоты сквалена,циклизация
сквалена в холестерин.
Холестеринемии:
1)Наследственная.
В
сыворотке крови увеличено содержание
холестерина, β-липопротеинов
Механизм
развития заболевания– отсутствие
или снижение количества рецепторов
клеток к ЛПНП, снижается захват и
катаболизм холестерина из ЛПНП,
увеличивается содержание холестерина
в плазме, оседание холестерина на стенки
сосудов, развитие атеросклеротических
бляшекОсложнения– ранний инфаркт миокарда, ксантоматоз,
инсульт
2)
Алиментарная гиперхолестеринемиявозникает от избытка в питании холестерина
3)Вторичная
гиперхолестеринемиявозникает
при гипотиреозе, сахарном диабете,
подагре, нефротическом синдроме
Атеросклероз:
Заболевание,
связанное с накоплением холестерина
в интиме сосудов с последующей
дегенерацией, отложением в очаг поражения
солей кальция, фиброзированием очага
и тромбозомДиагностические
критерии:гиперлипидемия,
гиперхолестеринемия
изменение
состава и соотношения транспортных
форм холестерина (увеличение ЛПНП и
уменьшение ЛПНП)Снижение
соотношения фосфолипиды
холестерин
Снижение
активности липопротеинлипазыУменьшение
в составе триацилглицеринов
полиненасыщенных жирных кислот и эфиров
холестерина
Способствуют
развитию атеросклероза:
наследственная
предрасположенность
гипертония
сахарный
диабет
ожирение
стрессы
гиподинамия
нарушение
равновесия свертывающей и противосвертывающей
системы крови.
Соседние файлы в предмете Биохимия
- #
- #
Источник
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
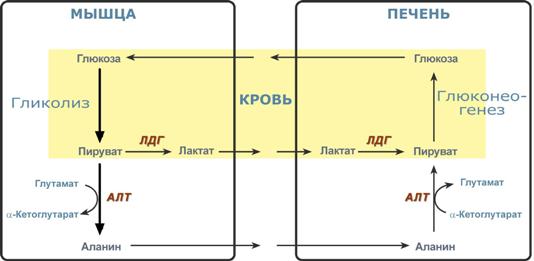
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
The Cori cycle (also known as the lactic acid cycle), named after its discoverers, Carl Ferdinand Cori and Gerty Cori,[1] is a metabolic pathway in which lactate produced by anaerobic glycolysis in muscles is transported to the liver and converted to glucose, which then returns to the muscles and is cyclically metabolized back to lactate.[2]
Process[edit]
Muscular activity requires ATP, which is provided by the breakdown of glycogen in the skeletal muscles. The breakdown of glycogen, known as glycogenolysis, releases glucose in the form of glucose 1-phosphate (G1P). The G1P is converted to G6P by phosphoglucomutase. G6P is readily fed into glycolysis, (or can go into the pentose phosphate pathway if G6P concentration is high) a process that provides ATP to the muscle cells as an energy source. During muscular activity, the store of ATP needs to be constantly replenished. When the supply of oxygen is sufficient, this energy comes from feeding pyruvate, one product of glycolysis, into the citric acid cycle, which ultimately generates ATP through oxygen-dependent oxidative phosphorylation.
When oxygen supply is insufficient, typically during intense muscular activity, energy must be released through anaerobic metabolism. Lactic acid fermentation converts pyruvate to lactate by lactate dehydrogenase. Most importantly, fermentation regenerates NAD+, maintaining its concentration so additional glycolysis reactions can occur. The fermentation step oxidizes the NADH produced by glycolysis back to NAD+, transferring two electrons from NADH to reduce pyruvate into lactate. (Refer to the main articles on glycolysis and fermentation for the details.)
Instead of accumulating inside the muscle cells, lactate produced by anaerobic fermentation is taken up by the liver. This initiates the other half of the Cori cycle. In the liver, gluconeogenesis occurs. From an intuitive perspective, gluconeogenesis reverses both glycolysis and fermentation by converting lactate first into pyruvate, and finally back to glucose. The glucose is then supplied to the muscles through the bloodstream; it is ready to be fed into further glycolysis reactions. If muscle activity has stopped, the glucose is used to replenish the supplies of glycogen through glycogenesis.[3]
Overall, the glycolysis steps of the cycle produce 2 ATP molecules at a cost of 6 ATP molecules consumed in the gluconeogenesis steps. Each iteration of the cycle must be maintained by a net consumption of 4 ATP molecules. As a result, the cycle cannot be sustained indefinitely. The intensive consumption of ATP molecules in the Cori cycle shifts the metabolic burden from the muscles to the liver.
Significance[edit]
The cycle’s importance is based on preventing lactic acidosis during anaerobic conditions in the muscle. However, normally, before this happens, the lactic acid is moved out of the muscles and into the liver.[3]
Additionally, this cycle is important in ATP production, an energy source, during muscle exertion. The end of muscle exertion allows the Cori cycle to function more effectively. This repays the oxygen debt so both the electron transport chain and citric acid cycle can produce energy at optimum effectiveness.[3]
The Cori cycle is a much more important source of substrate for gluconeogenesis than food.[4][5] The contribution of Cori cycle lactate to overall glucose production increases with fasting duration before plateauing.[6] Specifically, after 12, 20, and 40 hours of fasting by human volunteers, gluconeogenesis accounts for 41%, 71%, and 92% of glucose production, but the contribution of Cori cycle lactate to gluconeogenesis is 18%, 35%, and 36%, respectively.[6] The remaining glucose production comes from protein breakdown,[6] muscle glycogen,[6] and glycerol from lipolysis.[7]
The drug metformin can cause lactic acidosis in patients with kidney failure because metformin inhibits the hepatic gluconeogenesis of the Cori cycle, particularly the mitochondrial respiratory chain complex 1.[8] The buildup of lactate and its substrates for lactate production, pyruvate and alanine, lead to excess lactate.[9] Normally, the excess lactate would be cleared by the kidneys, but in patients with kidney failure, the kidneys cannot handle the excess lactic acid.
See also[edit]
- Alanine cycle
- Citric acid cycle
References[edit]
- ^ “Carl and Gerty Cori and Carbohydrate Metabolism”. American Chemical Society. 2004. Retrieved 12 May 2020.
- ^ Nelson, David L., & Cox, Michael M.(2005) Lehninger Principles of Biochemistry Fourth Edition. New York: W.H. Freeman and Company, p. 543.
- ^ a b c “Cori Cycle Archived 2008-04-23 at the Wayback Machine”. Retrieved May 3, 2008, from Elmhurst, pp. 1–3.
- ^ Gerich JE, Meyer C, Woerle HJ, Stumvoll M (2001). “Renal gluconeogenesis: Its importance in human glucose homeostasis”. Diabetes Care. 24 (2): 382–391. doi:10.2337/diacare.24.2.382. PMID 11213896.
- ^ Nuttall FQ, Ngo A, Gannon MC (2008). “Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?”. Diabetes/Metabolism Research and Reviews. 24 (6): 438–458. doi:10.1002/dmrr.863. PMID 18561209. S2CID 24330397.
- ^ a b c d Katz J, Tayek JA (1998). “Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans”. American Journal of Physiology. 275 (3 Pt 1): E537–E542. doi:10.1152/ajpendo.1998.275.3.E537. PMID 9725823.
- ^ Cahill GF (2006). “Fuel metabolism in starvation” (PDF). Annual Review of Nutrition. 26: 1–22. doi:10.1146/annurev.nutr.26.061505.111258. PMID 16848698.
- ^ Vecchio, S. et al. “Metformin accumulation: lactic acidosis and high plasmatic metformin levels in a retrospective case series of 66 patients on chronic therapy.”, Clin Toxicol. 2014;52(2).
- ^ Sirtori CR, Pasik C. “Re-evaluation of a biguanide, metformin: mechanism of action and tolerability”. Pharmacol Res 1994; 30.
Sources[edit]
- Smith, A.D., Datta, S.P., Smith, G. Howard, Campbell, P.N., Bentley, R., (Eds.) et al.(1997) Oxford Dictionary of Biochemistry and Molecular Biology. New York: Oxford University Press.
Источник
Цикл
Кори (глюкозо-лактатный цикл) открыла
чешская ученая, лауреат Нобелевской
премии Тереза
Кори.
Он представляет собой биохимический
транспорт лактата
из мышц в печень и дальнейший синтез
глюкозы
из лактата, катализируемый ферментами
глюконеогенеза:

При
интенсивной мышечной работе и в условиях
отсутствия или недостаточного числа
митохондрий
(например, в эритроцитах)
глюкоза
подвергается анаэробному гликолизу
с образованием лактата.
При накоплении лактата в мышцах возникает
лактат-ацидоз, раздражаются чувствительные
нервные окончания, что вызывает боль в
мышцах.
Лактат
переносится кровью в печень и превращается
в пируват, а затем в глюкозу (глюконеогенез),
которая с током крови может возвращаться
в работающую мышцу.
Направление
лактатдегидрогеназной реакции в
работающих мышцах и печени обусловлено
отношением концентраций восстановленной
и окисленной форм НАД+:
отношение НАД+/НАДН
в сокращающейся мышце больше, чем в
печени.
7.7. Спиртовое брожение
Спиртовое брожение
осуществляется дрожжеподобными
организмами, а также некоторыми плесневыми
грибками:
Механизм
реакции близок к гликолизу. Расхождение
начинается после этапа образования
пирувата. При гликолизе пируват при
участии фермента ЛДГ и кофермента НАДН
восстанавливается в лактат. При спиртовом
брожении пируват подвергается
декарбоксилированию, в результате
образуется ацетальдегид, а затем при
восстановлении его – этанол:
При молочнокислом
брожении ПВК не декарбоксилируется, а,
как и при гликолизе в животных тканях,
восстанавливается при участии ЛДГ за
счет водорода НАДН.
7.8. Пентозофосфатный путь превращения глюкозы
Пентозофосфатный
путь –
альтернативный путь окисления глюкозы.
Его функции:
–
поставляет клеткам кофермент НАДФН,
использующийся как донор водорода в
реакциях восстановления;
–
обеспечивает клетки пентозофосфатами
для синтеза нуклеотидов и нуклеиновых
кислот.
Пентозофосфатный
путь не приводит к синтезу АТФ.
Ферменты пути
локализованы в цитозоле.
В
пентозофосфатном пути превращения
глюкозы выделяют окислительный и
неокислительный пути образования
пентоз.
Окислительный
путь включает
две реакции дегидрирования. Коферментом
дегидрогеназ является НАДФ+,
восстанавливающийся в НАДФН. Пентозы
образуются при окислительном
декарбоксилировании.
Неокислительный
путь включает
реакции переноса 2- и 3-х углеродный
фрагментов с одной молекулы на другую.
Этот путь служит для синтеза пентоз.
Процесс обратим, и из пентоз могут
образовываться гексозы.
Пентозофосфатный
путь образования пентоз протекает в
печени, жировой ткани, молочной железе,
коре надпочечников, эритроцитах.
1).
Дегидрирование глюкозо-6-фосфата при
участии глюкозо-6-фос-фатдегидрогеназы
и кофермента НАДФ+
с образованием 6-фосфоглюконо--лактона
и НАДФН:
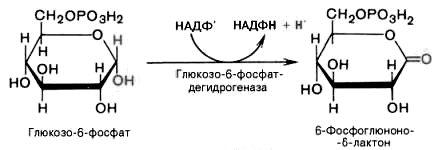
2).
6-фосфоглюконо--лактон
нестабилен и гидролизуется с образованием
6-фосфоглюконата (фермент –
6-фосфоглюконолактоназа):
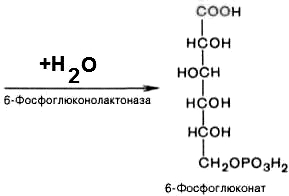
3).
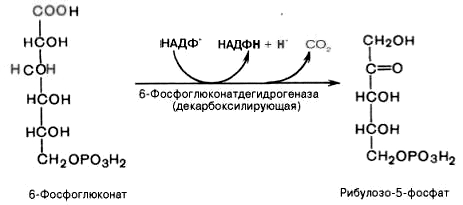
Дегидрирование и декарбоксилирование
6-фосфоглюконата с образованием
рибулозо-5-фосфата (пентоза) и НАДФН при
участии декарбоксилирующей
6-фосфоглюконатдегидрогеназы:
4).
Под действием эпимеразы из рибулозо-5-фосфата
образуется ксилулозо-5-фосфат (пентоза).
Под влиянием изомеразы рибулозо-5-фосфат
превращается в рибозо-5-фосфат (пентоза).
Между формами пентозофосфатов
устанавливается равновесие:
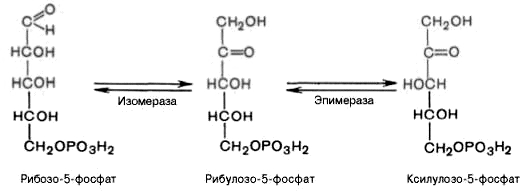
На
этом этапе пентозофосфатный путь может
быть завершен. При других условиях
наступает неокислительная стадия
пентозофосфатного цикла, протекающая
в анаэробных условиях. Она заключается
в переносе двух- и трехуглеродных
фрагментов от одной молекулы к другой.
При этом образуются вещества, характерные
для гликолиза (фруктозо-6-фосфат,
фруктозо-1,6-бисфосфат, фосфотриозы), и
вещества, специфические для пентозофосфатного
пути (седогептулозо-7-фосфат,
пентозо-5-фосфаты, эритрозо-4-фосфат).
Шесть
молекул
глюкозо-6-фосфата в пентозофосфатном
цикле
образуют 6 молекул
рибулозо-5-фосфата и 6 молекул
СО2.
Из 6 молекул
рибулозо-5-фосфата регенерируется 5
молекул
глюкозо-6-фосфата:
Промежуточные
продукты цикла (фруктозо-6-фосфат и
глицеральдегид-3-фосфат) включаются в
гликолиз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
