Антибиотикоассоциированный колит у детей
Эра антибиотиков (АБ) началась всередине ХХв. Широкое ибесконтрольное применение различных групп антибактериальных препаратов, особенно вамбулаторных условиях, привело кразвитию множества нежелательных эффектов, одним изкоторых является диарея. Еепоявление нафоне приема АБобозначается как АБ-ассоциированная диарея (ААД). Согласно определению ВОЗ, ААД характеризуется учащением стула (более 3 р./сут), которое возникает нафоне антибиотикотерапии или втечение 2мес. после ееокончания, сопровождается увеличением объема, изменением консистенции, появлением патологических примесей ввиде слизи, зелени икрови [1]. Поданным различных авторов, ААД развивается у5–30% лиц, получающих АБ[2, 3].
Ежегодно, согласно данным ВОЗ, в мире регистрируются 1–1,2 млрд диарейных заболеваний, а 5 млн случаев заканчиваются летальным исходом. Около 1,87 млн случаев смерти приходится на возраст до 5 лет. В России ежегодно заболевают диареей 500 тыс. детей [1]. Основную долю составляют диареи вирусной и бактериальной этиологии (рис. 1), в 6–7% случаев она обусловлена применением АБ.
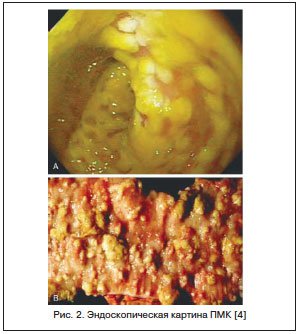
Считается, что в 20–25% случаев ААД отмечается в стационарах, но в последние годы увеличивается ее доля при назначении АБ в амбулаторной практике. Точных данных о частоте развития ААД у детей нет, т. к. чаще всего педиатры при подобной ситуации диагностируют дисбактериоз кишечника. У части пациентов ААД может иметь легкое течение, и при отмене АБ симптомы исчезают. Однако существуют тяжелые формы ААД, проявляющиеся псевдомембранозным колитом (ПМК). ПМК — острое, тяжелое заболевание толстой кишки, связанное с применением АБ и/или хирургическим вмешательством на кишечнике. ПМК характеризуется появлением на слизистой оболочке округлых фибринозных бляшек, сливающихся между собой, на фоне воспалительно-геморрагических изменений (рис. 2).
Механизмы развития диареи на фоне применения АБ:


1. Собственные побочные эффекты АБ (например, усиление перистальтики кишечника при приеме амоксициллина с клавулановой кислотой, макролидов, которые обладают мотилиноподобным действием на рецепторы кишечника) [5].
2. Осмотическая диарея в результате нарушения метаболизма желчных кислот и углеводов в кишечнике (например, при приеме фосфомицина трометамола) [6].
3. Избыточный рост бактерий в результате подавления облигатной интестинальной микрофлоры кишечника [7].
Практически все АБ, особенно активные в отношении анаэробов, способны вызывать ААД. Риск диареи возрастает при применении клиндамицина, линкомицина, аминопенициллинов, цефалоспоринов II и III поколения. По данным L. Mc Farland (1993), ААД встречается в 5–10% случаев при применении ампициллина, в 10–25% — цефалоспоринов II поколения и лишь в 2–5% случаев — при использовании других АБ, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин) [8]. Терапия цефалоспоринами III поколения предрасполагает к развитию ААД гораздо чаще, чем пенициллинами узкого спектра действия [9]. Следует помнить, что доза препарата, способ и кратность введения мало влияют на возможность развития ААД. Наиболее часто инфекция Clostridium (C.) difficile наблюдается при приеме АБ широкого спектра действия, которые плохо всасываются из кишечника, даже при их однократном введении.
Осмотическая и ААД в результате собственных побочных эффектов антибиотиков чаще всего протекает легко и требует отмены проводимой антибактериальной терапии или изменения пути введения «виновного» антибиотика. При ее развитии необходимо назначение препаратов — энтеросорбентов (Смекта®) от 3 до 7 дней и пробиотиков.
ААД этиологически может быть связана c воздействием различных микробов: C. difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибов рода Candida. Однако наиболее тяжелые формы ААД и ПМК обусловлены наличием C. difficile.
К факторам риска развития ПМК, обусловленного наличием C. difficile, относятся [3, 10, 11]:
- АБ, путь его выведения (чаще препараты, выводящиеся с желчью, например цефтриаксон), длительность антибактериального лечения, повторные курсы, комбинированная терапия разными группами АБ;
- возраст больных (у больных до 5 лет и старше 60 лет частота обнаружения C. difficile увеличивается);
- длительная госпитализация больного (прямо пропорциональна частоте колонизации C. difficile), пребывание в одной палате с больным, имеющим манифестную форму инфекции;
- наличие тяжелых сопутствующих заболеваний (патология ЖКТ, иммунодефицитные состояния, почечная недостаточность, онкология);
- проводимые медицинские манипуляции (операции, инвазивные процедуры).
C. difficile — грамположительный спорообразующий анаэроб, устойчив к воздействию алкогольсодержащих антисептиков, чувствительный к кислой среде желудка (при рН ниже 3,5) [12]. Особенностью жизненного цикла C. difficile является развитие 2-х форм — вегетативной и спор. Споры чрезвычайно устойчивы к различным внешним агрессивным воздействиям и могут оставаться жизнеспособными в течение многих лет в окружающей среде [13]. Вегетативные формы C. difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы энтеротоксин (токсин, А) и цитотоксин (токсин В), повреждающие кишечную стенку [14].
На сегодняшний день доказано, что токсин, А повышает секрецию жидкости в просвет кишечника, способствуя развитию диареи. Токсин В ингибирует процессы синтеза белка в энтероцитах и колоноцитах, оказывает выраженное цитопатогенное действие, нарушая функции клеточных мембран и приводя к потере калия и развитию выраженных электролитных нарушений. Токсин В действует только в присутствии токсина, А, повреждая мембраны в тысячу раз сильнее. Энтеротоксичность C. difficile реализуется 2-мя путями: прямой эффект заключается в непосредственном действии токсинов на энтероциты и нервный аппарат кишечной стенки; непрямой обеспечивается за счет активации макрофагов, тучных клеток и увеличения продукции провоспалительных цитокинов.
В исследованиях, проведенных в Европе и Америке, отмечается, что токсигенные штаммы C. difficile связаны с госпитальными вспышками и являются причиной генерализации инфекции, продуцируя значительно больше токсинов [15–17]. Споры C. difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезинфицирующим средствам, а вегетативные формы резистентны к большинству АБ (природные и полусинтетические пенициллины, ингибитор-защищенные пенициллины, цефалоспорины, линкозамиды и др.) [12].
Инфицирование C. difficile осуществляется фекально-оральным путем, резервуаром могут быть бактерионосители, пациенты и медработники, а также контаминированные поверхности в стационарах и амбулаториях [18]. Контактно-бытовой путь передачи C. difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Кроме этого, контингентами риска по развитию тяжелых форм нозокомиальной C. difficile-инфекции являются дети раннего возраста, ослабленные, а также пациенты, длительно находящиеся в стационаре [19, 20].
Клинические варианты течения C. difficile-ассоциированной диареи у детей могут быть малосимптомными или тяжелыми, вплоть до развития ПМК. Легкое течение часто характеризуется клиническими проявлениями нетяжелого колита (энтероколита), без лихорадки и интоксикации. Дети могут отмечать появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается увеличение количества дефекаций в сутки, часто не приводящее к водно-электролитным нарушениям [18]. В некоторых случаях отмечаются усиление болей в животе, его вздутие, нарастание интоксикации и диареи с прогрессированием процесса при отсутствии адекватной терапии [9].
Клинические проявления ПМК у детей разнообразны и развиваются остро. Для детей младшего возраста характерны лихорадка, отказ от еды, нарастание интоксикации, срыгивания, диарея с водно-электролитными нарушениями и вздутием живота, болезненной пальпацией живота по ходу толстой кишки [9, 18]. Стул частый, в каловых массах — примесь слизи и иногда крови. Иногда большая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение ПМК может осложниться кишечным кровотечением, перфорацией кишечника с развитием перитонита [18]. Для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами инфекции C. difficile необходимо совместное наблюдение педиатром и хирургом [19, 20].
При бактерионосительстве C. difficile и легких вариантах ААД изменений в клиническом анализе крови обычно не отмечается. При манифестных формах инфекции изменения в крови характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево и увеличением СОЭ. Водянистая диарея как главный симптом C. difficile-инфекции обычно появляется через несколько дней после колонизации C. difficile. У каждого четвертого пациента C. difficile-инфекция с диареей сопровождается лихорадкой, болью внизу живота и судорогами на фоне электролитных нарушений, у половины больных в анализе крови отмечается выраженный лейкоцитоз [21].
У здоровых детей бессимптомное носительство C. difficile не требует проведения лечебных мероприятий. При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых АБ. Этиотропная терапия должна назначаться в каждом случае индивидуально, с учетом возраста ребенка, тяжести заболевания и фоновых состояний [19].
У детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ), даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным.
C. difficile-ассоциированная диарея легкого и среднетяжелого течения у детей протекает с клиническими симптомами нетяжелого колита/энтероколита и чаще без лихорадки и с незначительной интоксикацией. Отмечаются умеренные боли в животе, самостоятельные и/или при пальпации, метеоризм, умеренное учащение дефекации, как правило, не приводящее к выраженным водно-электролитным нарушениям. В терапии таких вариантов течения хорошо зарекомендовали себя симптоматические препараты, обладающие энтеросорбирующим, цитопротективным и вяжущим эффектами.
У детей с высоким риском развития ААД стоит уделить внимание профилактике данных состояний, выбирая энтеросорбент, обладающий не только сорбирующими, но и протективными свойствами. И в этом смысле диоктаэдрический смектит (Смекта®) является препаратом выбора, т. к. обладает цитомукопротективными свойствами [22].
В 2008 г. совместная рабочая группа ESPGHAN и ESPID опубликовала научно обоснованные рекомендации по применению противодиарейных препаратов, которые оправданно использовать в качестве дополнительной терапии диарейного синдрома у детей. Среди энтеросорбентов рекомендован диоктаэдрический смектит (Смекта®) с высоким уровнем доказательности (II, B) в комплексе с оральной регидратацией [23]. Диоктаэдрический смектит обладает текучестью и обволакивающей способностью, предохраняет слизистую оболочку кишечника от воздействия агрессивных и токсических факторов. Диоктаэдрический смектит проникает в муциновый слой и изменяет физические свойства слизи, увеличивая энзиматическую активность гликокаликса, тем самым снижая потерю электролитов и воды с калом [24]. Являясь селективным сорбентом, диоктаэдрический смектит выводит из организма бактерии, вирусы, токсины, желчные кислоты, избыточное количество углеводов и уменьшает количество газа [25].
При острых состояниях оправданно применение двойной суточной дозировки диосмектита в течение первых 3-х дней терапии [30]. Смекта® является топическим препаратом и имеет высокий профиль безопасности, т. к. не всасывается из ЖКТ, что позволяет создать в просвете кишки высокую концентрацию активного вещества; при этом препарат быстро и полностью выводится из организма.
Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, сохраняющаяся диарея после отмены АБ, а также рецидив инфекции на фоне повторного приема АБ. C. difficile высокочувствительны к метронидазолу, ванкомицину и фидаксомицину. При этом стартовую этиотропную терапию C. difficile-инфекции в большинстве случаев начинают с введения метронидазола, который считается препаратом выбора. Ванкомицин является альтернативным АБ для лечения данной инфекции и назначается как препарат первой линии лишь в тех случаях, когда введение метронидазола противопоказано (индивидуальная непереносимость, тяжелые поражения печени и нервной системы, выраженная лейкопения). Фидаксомицин в настоящее время для использования в РФ не зарегистрирован.
Метронидазол для лечения C. difficile-инфекции применяется в дозе 30 мг/кг/сут, вводится ребенку в 3–4 приема. В отличие от ванкомицина метронидазол может вводиться как перорально, так и парентерально — путем в/в инфузии. В тех случаях, когда у ребенка с C. difficile-инфекцией выражены тошнота, срыгивания и/или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить в/в введение метронидазола на его пероральный прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность — 80–100%) [26].
Ванкомицин — АБ из группы гликопептидов также обладает выраженным бактерицидным действием на C. difficile. Однако при C. difficile-инфекции его рекомендовано использовать как препарат второй линии, когда отсутствует клинический эффект стартовой терапии, либо в качестве альтернативного АБ у детей с противопоказаниями к применению метронидазола. Ограничения к широкому использованию ванкомицина объясняются попыткой снизить риск развития устойчивости к нему грамположительной флоры, в первую очередь стафилококков и энтерококков. Это связано с тем, что ванкомицин в настоящее время — один из немногих антибактериальных препаратов, эффективных при инфекциях, вызванных метициллин-резистентными штаммами стафилококка. В случаях необходимости применения ванкомицина при C. difficile-инфекции используется только пероральный способ его введения [6, 27]. В исследовании F. A. Zar et al. (2007) установлено, что ванкомицин (пероральный путь введения) имеет преимущество перед метронидазолом (чувствительность к ванкомицину 97% против 76% к метронидазолу). Однако в связи с высокой стоимостью ванкомицина и развитием резистентности к нему некоторых микроорганизмов в качестве препарата первой линии рекомендуется метронидазол [28].
Фидаксомицин — новый представитель узкоспектральных макролидов. Это продукт ферментации актиномицет Dactylosporangium aurantiacum. У него отсутствуют системные эффекты, минимальна абсорбция в кровоток, он обладает бактерицидным действием и выраженной антагонистической активностью к C. difficile с самым минимальным влиянием на нормальную микрофлору. В экспериментах показывает способность снижать частоту повторяющихся инфекций C. difficile. Выпускается в таблетках по 200 мг, назначается 2 р./сут с интервалом 12 ч на 10 дней. Экскретируется со стулом (>90%), незначительная часть — с мочой (0,59%). На данный момент препарат отличается высокой стоимостью, как уже упоминалось, не зарегистрирован в РФ. За рубежом необходимость его применения до сих пор является предметом дискуссии, отсутствуют исследования безопасности его применения у пациентов с воспалительными заболеваниями кишечника.
После отмены антимикробных препаратов детям, перенесшим C. difficile-инфекцию, для полной санации кишечника от спор возбудителя целесообразно провести курсовое лечение пробиотиками [29]. В результате 15 из 16 исследований у пациентов с ААД доказана значимость применения пробиотиков по сравнению с плацебо или без их применения. Для оценки эффективности и безопасности применения пробиотиков в терапии ААД использованы 11 критериев. В настоящее время можно говорить об эффективности применения Lactobacillus rhamnosus и Saccharomyces boulardii в дозе ≥5 млрд КОЕ/сут, для других штаммов рекомендуется проведение дополнительных исследований.
Согласно рекомендациям ESPGHAN и ESPID по применению противодиарейных препаратов, обновленным в 2014 г., диоктаэдрический смектит (Смекта®) в сочетании с пробиотиками Lactobacillus GG эффективен в терапии острой диареи у детей раннего возраста.
Профилактика C. difficile-инфекции заключается в строгом соблюдении правил личной гигиены, а также в неукоснительном выполнении всех требований по соблюдению санитарно-противоэпидемического режима лечебных учреждений. Нельзя также недооценивать и такой фактор профилактики C. difficile-инфекции, как уменьшение частоты бесконтрольного и необоснованного использования АБ.
Заключение
Таким образом, основными резервами снижения заболеваемости у детей C. difficile-инфекцией являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников. Дополнением к перечисленным видам профилактики и лечения C. difficile-инфекции являются различные методы восстановления микробиоты кишечника: прием препарата Смекта® и пробиотиков.
Источник
Авторы клинического разбора:
Корнеева Ольга Николаевна – кандидат медицинских наук, врач клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Первого МГМУ им И.М. Сеченова
Ивашкин Владимир Трофимович – академик РАМН, профессор, заведующий кафедрой проведевтики внутренних болезней и директор клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Первого МГМУ им И.М. Сеченова.
В клинику обратился пожилой мужчина 62 лет с жалобами на жидкий стул до 8 раз в сутки, повышение температуры тела до 38-39С, боль в околопупочной области спастического характера, общую слабость и похудание на 7 кг в течение месяца.
Из анамнеза известно, что за 20 дней до момента поступления лечился в районной больнице по поводу бронхопневмонии. Проводилась антибиотикотерапия цефалоспорином III поколения. На фоне лечения пневмония разрешилась, и больной был выписан в удовлетворительном состоянии. Через 3 дня после окончания приема антибиотика отметил появление частого водянистого стула, появилась общая слабость. Пациент самостоятельно начал прием левомицетина и лоперамида. После чего наступило резкое ухудшение состояния – появилась лихорадка до 39С с ознобом, выраженная общая слабость, сохранялась диарея. Больной обратился к врачу поликлиники, где было рекомендовано исследование кала для исключения кишечных инфекций. Исследование кала на дизгруппу возбудителей кишечных инфекций не выявило. В связи с сохранением вышеперечисленных жалоб больной был госпитализирован в нашу клинику.
При объективном осмотре состояние средней тяжести, 38С, кожа и видимые слизистые бледные, язык сухой, живот увеличен в объеме за счет метеоризма, при пальпации умеренно болезненный по ходу толстой кишки.
Требовалось установить предварительный диагноз. Отрицательные результаты исследования кала на дизгруппу ставили под сомнение наличие кишечной инфекции, дебют воспалительных заболеваний кишечника у мужчины в 62 года представлялся маловероятным. Имеющиеся факторы риска антибиотикоассоциированного колита – прием антибиотиков, пожилой возраст, наличие сопутствующей патологии (ишемическая болезнь сердца, гипертоническая болезнь) свидетельствовали с высокой вероятностью о наличии антибиотикассоциированного колита, тяжелого течения (псевдомембранозный?).
Было начато обследование. В анализах крови обращали на себя внимание нормохромная железодефицитная анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево вплоть до миелоцитов, тромбоцитоз и ускорение СОЭ. Также выявлена гипонатриемия, гипоальбуминемия, снижение уровня железа, резкое повышение уровня С-реактивного белка, реакция кала на скрытую кровь с бензидином – положительная. При исследовании кала методом ИФА обнаружены токсины А и В C.difficile. Для исключения дилатации толстой кишки был сделан обзорный снимок брюшной полости в положении лежа – ширина петель в пределах нормы. При ультразвуковом исследовании брюшной полости обращало на себя внимание утолщение стенок толстой кишки до 10 мм. Утолщение стенок толстой кишки, сужение просвета кишки отмечалось и при компьютерной томографии органов брюшной полости.
При сигмоскопии: аппарат введен в сигмовидную кишку, на осмотренных участках слизистая умеренно гиперемирована, с множественными белесоватыми включениями. Слизистая прямой кишки гиперемирована, отёчна. Заключение: антибиотикоассоциированный колит (псевдомембранозный). (Рис. 2).
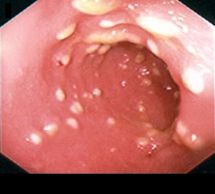
Рис. 2. Сигмоскопия
Морфологическая картина соответствовала псевдомембранозному колиту: выявлялся некроз эпителия, фибриновый выпот с нейтрофилами, типичные изъязвления слизистой напоминающие извержения вулкана, формирование псевдомембран (Рис.3).
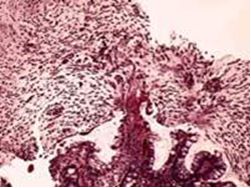
Рис. 3. Морфологическая картина псевдомембранозного колита
Таким образом, был установлен следующий клинический диагноз: Антибиотикоассоциированный колит, тяжелого течения (псевдомембранозный). Синдром нарушенного всасывания: железодефицитная анемия. Гипоальбуминемия.
Лечение больного включало регидратационную терапию, парентеральное питание, с дальнейшим переводом на энтеральное питание, метронидазолом 500 мг в/в каждые 6 ч, ванкомицином 250 мг 4 раза в сутки. Пробиотические препараты не назначались. На фоне лечения состояние больного улучшилось, нормализовалась температура тела, постепенно уменьшилась частота стула и общая слабость, больной прибавил в весе и был выписан в удовлетворительном состоянии.
Через 2 недели после выписки из стационара больному была назначена антибиотикотерапия после экстракции зуба, которая была прервана на 2-е сутки в связи с возникновением диареи. Больной обратился в нашу клинику. Был заподозрен рецидив C.difficile-ассоциированного колита, что было подтверждено обнаружением токсинов C.difficile в кале. Назначена терапия ванкомицином в начальной дозе 500 мг 2 раза в сутки с последующим постепенным снижением дозы в комбинации с пробиотическим препаратом Флорасан А по 1 капсуле 3 раза в день на 14 дней. Состояние больного быстро улучшилось, в течение 1 года наблюдения рецидивов диареи не отмечалось.
Пробиотические препараты (Флорасан А) оказывают отчетливый эффект в лечении антибиотикоассоциированного колита, что делает актуальным включение пробиотиков в схемы лечения. Важными элементами профилактики антибиотикоассоциированных поражений кишечника служат дифференцированное назначение антибиотиков под строгим и обязательным контролем врача, а также обязательное назначение пробиотиков одновременно с началом антибактериальной терапии.
Источник
