Анаболические стероиды при колитах
…, ., .., .
.
— , . , , . . . , . , , . , . : – «» , ; – , , – , , . , , , .
. «» . , 35–60% , 90% , — . . ? . 4% , — 30%. 2–3 . , , . , , . — , , . , – , , . : 3 , .
— , : — 20 , ( 20 40 ) (40–80 ). 60–70% , , , . , , . . , «» . . , . , . , . , 100 . , .
, , «» – , , , «» . 50- , . , . ( 20–40 /, — 100–250 / .) , – . , «» . 5- (5-). 5- , , . , . , 5- — 1 4 . 287 , 5- 1, 2 4 /10/. 27% , 5- — 67, 65 75% . , 8 /. , 5-. 2 /. 90% , . , 5- 4 . – , , .
, . , . 5- , . , . , 5-. , . 1–2 , , – — 6–8 . 2–3 . 5- , 5- . .
. 5- ? , , «» 5-. ( , , , ) – . . , 60% , 90% — . , . , «» , . 4–6 . 0,5 , 2 / ( «»). , , 1 , 2–3 . – . «» 5- (, , ). 5- – . 5- >7, — >6, — . , . 5-, , , . Sutherland et al. /32/ – 8 , 1000 , 5- . : ) 2,0 , OR — 1,5; 95%; CI — 0,89–2,6; ) 2,0 2,9 /, OR — 1,9; 95%; CI — 1,3–2,8; ) 3,0 , OR — 2,7; 95%; CI — 1,8–3,9. 80% 5- 2,0–4,8 /. , 5-.
, . . . «» 5- — . 5- – . , 5- .
. 400 / 120 / 5–7 , 1,0–1,5 / . 3 , . 80%. . . , , : — , — , , , , . , , , . «» . 30 /, , . D. , – , , .
: 1) ; 2) ; 3) , , , .
– , . – 1 / 100 / 3- . . 10–14 . , « ». , .
, , . . — . 10 / 3 /7/. : , , / .
. , 40 . . – , , « ». . : 1 (5 ) 10 5 6–10 . ó .
() . , 2/3 . , (9 /) 30 . .
, . 20- , 40–80% . 4 . , 3 . (2,0–2,5 /) ( 6 ). , . . , — 0,3% . 11,1% , 50%.
, . , . , 25 / / . . . , . 5 , . .
, , . / 5 / , 8 — . – . .
— , . «» . , 5 , — 6–8 — 5- — . . , — . -, — . /1/. . , , , /8/.
5 / . – , -2 -. . 40–69% . / 2–4 / 500 / 7–10 . 5–8 / 300 /. , 5 / . 3 , , . ( , ) , , . 64% . 80 170 / – . , , .
— . . -. , . /24, 29/. 364 , ( 5-), 5 /, 10 / . 0, 2 6 , 8 . , 60–62% 5 / 8 31–34% — (P<0,001). , 54 (46 18%). . , / /12/. , – . , . . , . , . , . , , 1 . . , , , , .
, , . , , . 2 /, «» . -, «» , (OR — 1,29; 95%; CI — 1,06–1,57) /33/. – , , /11/. -, , 5-. 2,4 / , 1,6 /, 3 , 2 /. , , /4/. . . , 5- (OR — 2,41; 95%; CI — 1,05–5,54) /19/, (OR — 2,03; 95%; CI — 1,28–3,20) /20/, ( + ) /6, 25/. — . , . 5- 2–4 . . , 5- E.coli Nissle 1917 , 5- /15, 23/.
, . , «» . 4, , , , , .
-3 () 5- , 4. /17/. , 5–22 6 . , 25–30% /28/. , . (, , ), . 91 65% /3/. , , . , 105 5- Plantago ovata (). , /9/. , , . , , /13/. , — . , , /26/. , , , . -1 , 4 , 5 9 /35/. / (2 / 2–5 , — 200–700 / 2 3–6 ) /16/. – , . , «» . . /36/.
— , , , /31/. , . , 20 // . 12 88% 100% — /21/. — (FK-506) — . . , /2, 14, 18/.
. . . , 80% 33% /30/, . , 1 22,5 , 2–3 — 7,5 /27/. – 0,5 /. 12 – 60% /34/. CD3 /22/, -2 /5/. , CD25, , , , .
, , , . , , . , .. , , .
1. Ayabe T., Imai S., Ashida T. et al. Glucocorticoid receptor beta expression as a novel predictor for therapeutic efficacy of corticosteroid in patients with ulcerative colitis// Gastroenterology.-1998.-114.- A 924.
2. Bloom S., Kiilerich S., Lassen M.R. et al. Randomized trial of Tinzaperin, a low molecular weight heparin (LMWH) versus placebo in the treatment of mild to moderately active ulcerative colitis// Gastroenterology.- 2003 – 124.- 4.- Suppl. 1.- P. 540.
3. Breuer R.I., Soergel K.H., Lashner B.A. et al. Short chain fatty acid rectal irrigation for left-sided ulcerative colitis: A randomized, placebo controlled trial// Gut.-1997.-40.-4.- P. 485–491.
4. Casellas F., Vaquero E., Armengol J.R., Malagelada J.R. Practically of 5-aminosalicylic suppositories for long-term treatment of inactive distal ulcerative colitis// Hepato-Gastroenterology.- 1999.- 46.- 28.- P. 2343–2346.
5. Creed T., Hearing S., Probert Ch. et al. Basiliximab (IL-2 Receptor antagonist) as a steroid sensitizing agent in steroid resistant ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 65.
6. D’Albasio G., Pacini F., Camarri E. et al. Combined therapy with 5-aminosalicylic acid tablets and enemas for maintaining remission in ulcerative proctitis: a randomized double-blind study// Am. J. Gastroenterol.- 1997.- 92.- P. 1143–1147.
7. ECCO Consensus on the Management of Crohn’s disease// Gut.- 2006.- 55 (Suppl.1).
8. Farrel R.J., Murphy A., Long A. et al. High multidrug resistance ( P-glycoprotein 170) expression in inflammatory bowel disease patients who fail medical therapy// Gastroenterology.- 2000.- 118.- P. 279–288.
9. Fernandez-Banares F., Hinojosa J., Sanches-Lombrana J.L. et al. Randomized clinical trial of Plantago ovata seeds (dietary fiber) as compared with mesalamine in maintaining remission in ulcerative colitis// Am. J. Gastroenterol.- 1999.- 94.- P. 427–433.
10. Hanauer S.B. Dose-ranging study of mesalamine (pentasa) enemas in the treatment of acute ulcerative proctosygmoiditis : Results of a multicentered placebo-controlled trial// Inflam. Bowel Dis.- 1998.- 4.- 79–83.
11. Hanauer S.B., Meyers S., Sachar D.B. The pharmacology of anti-inflammatory drugs in inflammatory bowel disease./ In: Kirsner J.B., Shorter R.G., ed. Inflammatory bowel disease.- 4th ed.- Baltimore.- Williams and Wilkins.- 1995.- 643–663.
12. Jarnerot G., Hertervig E., Friis-Liby I. et al. Inflixomab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study// Gastroenterology.- 2005.- 128.- P. 1805–1811.
13. Kanauchi O., Mitsnyama K., Andoh A. et al. Beneficial effects of prebiotics, germinated barley foodstuff, in the long term treatment of ulcerative colitis: a multi-center open control study// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 1749.
14. Korzenik J., Miner P., Stanton D. et al. Multicenter, randomized, double-blind, placebo-controlled trial of Deligoparin (ultra low molecular weight heparin) for active ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 539.
15. Kruis W., Schutz E., Fric P. et al. Double-blind comparison of an oral Echerichia coli preparation and mesalazine in maintaining remission of ulcerative colitis// Aliment. Pharmacol. Ther.- 1997- 15.- P. 853–858.
16. Levine D.S., Fischer S.H., Christie G.L. et al. Intravenous immunoglobulin therapy for active, extensive, and medically refractory idiopathic ulcerative colitis and Crohn’s disease// Am. J. Gastroenterol.- 1992.- 87.- P. 91–100.
17. Loeschke K., Ucberschaer B., Pietsch A. et al. N-3 fatty acids retard early relapse in ulcerative colitis// Abstract. Book AGA.- 1996.- A 781.
18. Marc A., De Bievre, Anton A. et al. A randomized, placebo-controlled trial of low molecular weight heparin in active ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 543.
19. Marshall J.K., Irvine E.J. Rectal aminosalicylate therapy for distal ulcerative colitis: a meta-analysis// Aliment. Pharmacol. Ther.- 1995.- 9.- 293–300.
20. Marshall J.K., Irvine E.J. Rectal corticosteroids vs. alternative treatment in ulcerative colitis: a meta-analysis// Gut.- 1997.- 40.- P. 775–781.
21. Orth T., Reters M., Schlaak J.F. et al. Mycophenolate mofetil versus azathioprine in patients with chronic active ulcerative colitis: a 12-month pilot study// Am. J. Gastroenterol.- 2000.- 95.- P. 1201–1207.
22. Plevy S.E., Salzberg B.A., Regueiro M. et al. A humanized anti-CD3 monoclonal antibody, Visilizumab, for treatment of severe steroid-refractory ulcerative colitis: Preliminary results of a phase 1 study// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 62.
23. Rembacken B.J., Snelling A.M., Hawkey P.M. et al. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomized trial// Lancet.- 1999.- 21.- P. 635–639.
24. Rutgeerts P., Feagan B., Olson A. et al. A randomized placebo-controlled trial of infliximab therapy for ulcerative colitis: Act 1 tria.// Gastroenterology.- 2005.- 128.- A 689.
25. Safdi M., DeMicco M., Sninsky C. et al. A double blind comparison of oral vs. rectal mesalamine vs. combination therapy in the treatment of distal ulcerative colitis// Am. J. Gastroenterol.- 1997.- 92.- P. 1867–1871.
26. Saibil F.G. Lidocaine enemas for intractable distal ulcerative colitis: efficacy and safety// Gastroenterology.- 1998.- 114.- Pt 2.- P. 4395.
27. Sakuraba A., Naganuma M., Hibi T., Ishii H. Intensive therapy of granulocyte and monocyte absorption apheresis induces rapid remission in patients with ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl 1.- T. 1379.
28. Sandborn Q., Tremaine W., Offord K. et al. Transdermal nicotine for mildly to moderately active ulcerative colitis// Ann. Intern. Med.- 1997.- 126.- P. 364–371.
29. Sandborn W., Rachmilewitz D., Hanauer S. et al. Infliximab induction and maintenance therapy for ulcerative colitis: the Act 2 tria.// Gastroenterology.- 2005.- 128 (suppl.2).- A 688.
30. Sawada K., Kusugam K., Suzuki Y. et al. Multicenter randomized double blind controlled trial for ulcerative colitis therapy with leukocytapheresis// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- P. 542.
31. Skelly M.M., Curtis H., Jenkins D. et al. Toxicity of mycophenolate mofetil (MMF) in patients with inflammatory bowel disease (IBD)// Gastroenterology.- 2000.- 14.- P. 171–176.
32. Sutherland L.R., May G.R., Shaffer E.A. Sulphasalazine revisited: a meta-analysis of 5-aminosalicylic acid in the treatment of ulcerative colitis// Ann. Intern. Med.- 1993.- 118.- P. 540–549.
33. Sutherland L., Roth D., Beck P. et al. Alternative to sulphasalazine: a meta-analysis of 5-ASA in the treatment of ulcerative colitis// Inflam. Bowel Dis.- 1997.- 3.- P. 665–678.
34. Tilg H., Vogelsang H., Ludwiczek O. et al. A randomized placebo-controlled trial of pegylated interferon alpha in active ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl .1.- P. 472.
35. Van Assche G., Noman M., Asnong K., Rutgeerts P. The use of the neurokinin-1 receptor Antagonist, SR-140333B, Nolpitantium Besilate, in mild to moderate active ulcerative colitis// Gastroenterology.- 2003.- 124.- 4.- Suppl. 1.- T 1377.
36. Wright J.P., Winter T.A., Candy S., Marks I. Sucralfate and methylprednisolone enemas in active ulcerative colitis — a prospective, single-blind study// Dig. Dis. Sci.- 1999.- 44.- 9.- P. 1899–1901.
Источник
В статье рассмотрена роль системных и топических кортикостероидов в терапии язвенного колита
Язвенный колит (ЯК) представляет собой хроническое идиопатическое воспалительное заболевание с повреждением слизистой оболочки толстой кишки. При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением фульминантного колита) и носит диффузный характер. ЯК характеризуется периодами активного проявления симптомов заболевания, которые перемежаются периодами клинической ремиссии [1]. В 2012 г. статистический анализ показал, что в мире распространенность ЯК достигла 249 на 100 тыс. человек в Северной Америке и 505 на 100 тыс. человек в Европе; самые высокие годовые показатели заболеваемости ЯК были 19,2 на 100 тыс. человеко-лет в Северной Америке и 24,3 на 100 тыс. человеко-лет в Европе [2]. Самый высокий уровень заболеваемости, по-видимому, отмечается в возрасте 20–30 лет, хотя есть некоторые доказательства второго пика заболеваемости в более позднем возрасте [2]. Однако наличие второго пика заболеваемости признается не всеми специалистами, занимающимися воспалительными заболеваниями кишечника (ВЗК).
Эндоскопическое исследование толстой кишки у больных ЯК выявляет ряд характерных повреждений слизистой оболочки толстой кишки (СОТК): отсутствие сосудистого рисунка, гиперемию, зернистость, контактную кровоточивость, наличие эрозий и язв [1, 3]. В настоящее время заживление СОТК при ЯК рассматривается как одна из ключевых конечных точек в клинических исследованиях, а достижение заживления СОТК в клинической практике – как реальная возможность изменить течение ЯК и сохранить функции кишечника. В исследованиях последних лет показано, что заживление СО как при ЯК, так и при болезни Крона (БК) достоверно связано с большей продолжительностью клинической ремиссии заболевания, более низкой частотой рецидивов, более низким риском развития колоректального рака и более высоким качеством жизни [4, 5], а также существенно меньшей частотой кол-эктомий [6].
Существующие руководства по лечению взрослых больных ЯК в США [7], Европейском союзе [8] и Российской Федерации [9] рекомендуют в качестве первой линии терапии для индукции ремиссии у пациентов с легкой и среднетяжелой формами ЯК препараты 5-аминосалициловой кислоты (5-АСК). Такое лечение считается наиболее эффективным при комбинации системных и пероральных препаратов 5-АСК [7–9]. В случае неэффективности 5-АСК препаратами второй линии являются глюкокортикостероиды (ГКС) [7–9]. Однако ГКС I поколения, такие как преднизолон, имеют ряд побочных эффектов: повышенный риск развития инфекционных осложнений, остеопороза, синдрома Иценко – Кушинга, развитие стероидного диабета, симптоматической гипертензии и даже повышенный риск смертности по сравнению с таковым в общей популяции [7, 10–12].
В настоящее время для лечения ВЗК применяется несколько глюкокортикоидов топического действия для приема внутрь и для ректального введения: будесонид, тиксокортола пиволат, беклометазон, флютиказон [13]. В России с 2004 г. зарегистрирован и успешно применяется препарат Буденофальк (компания Dr. Falk, Германия) в форме капсул для приема внутрь. Одна капсула Буденофалька содержит 3 мг будесонида. При ряде заболеваний, например при бронхиальной астме и сезонном аллергическом рините, будесонид так же эффективен, как системные ГКС, отличаясь при этом лучшей переносимостью и меньшим влиянием на гипоталамо-гипофизарно-адреналовую систему. Это послужило основанием для применения будесонида при БК. Будесонид является первым топическим кортикостероидом, имеющим сродство к глюкокортикоидным рецепторам приблизительно в 8,5, 15 и 195 раз больше, чем у дексаметазона [14], преднизолона [15] и гидрокортизона [15] соответственно. Кроме того, будесонид почти не всасывается из кишечника, характеризуется низкой системной биодоступностью (не более 10% по сравнению с таковой преднизолона и гидрокортизона) и быстрым пресистемным метаболизмом. Последнее обеспечивает отсутствие токсичных метаболитов в крови после первого прохождения препарата через печень. Однако наиболее высокая внутрипросветная концентрация действующего вещества и, соответственно, наибольшая эффективность Буденофалька достигаются, начиная с терминального отдела подвздошной кишки и до поперечной ободочной кишки.
ЯК – это хроническое заболевание, поражающее только СОТК, сопровождающееся ее воспалением, отеком и образованием язвенных дефектов. Воспаление всегда начинается с прямой кишки, непрерывно распространяясь выше вплоть до поражения СО всех отделов толстой кишки. Таблетированный мультиматричный (ММХ) будесонид является представителем II поколения кортикостероидов, созданным для доставки активного вещества на протяжении всей толстой кишки. В фармакокинетических исследованиях среднее относительное всасывание будесонида в месте между восходящей кишкой и нисходящей/сигмовидной кишкой составило 95,9% (рис. 1) [16]. В 2-х похожих по дизайну исследованиях 3-й фазы (CORE I и II) однократный ежедневный прием будесонида ММХ 9 мг оказался эффективным и хорошо переносимым для индукции ремиссии ЯК легкой и средней степени тяжести. Частота клинической и эндоскопической ремиссии составила 17,9% (CORE I) и 17,4% (CORE II) для будесонида ММХ 9 мг по сравнению с плацебо 7,4% и 4,5% соответственно (p<0,05, будесонид ММХ 9 мг по сравнению с плацебо в обоих исследованиях), 12,1% с месалазином 2,4 г и 12,6% с будесонидом 9 мг, высвобождаемым в подвздошной кишке. По данным исследования поддерживающей терапии будесонидом в течение 12 мес., будесонид ММХ 6 мг может удлинять время до рецидива заболевания: среднее время составило 1 год для будесонида ММХ 6 мг по сравнению с 181 днем (р=0,02) для плацебо; однако необходимы дальнейшие исследования. В исследованиях CORE будесонид ММХ проявил хороший профиль безопасности; большинство нежелательных явлений (НЯ) были легкими или умеренными по своей интенсивности, серьезные НЯ были очень редкими. Более того, частота побочных реакций, возможно, связанных с глюкокортикоидами, была сравнима среди групп лечения. Долгосрочная безопасность (12 мес.) будесонида ММХ была сравнима с таковой плацебо. Эти данные подтверждают возможность включения ММХ будесонида в алгоритм лечения ЯК [17–20].
Будесонид ММХ для лечения и индукции ремиссии ЯК
Эффективность и безопасность будесонида ММХ для индукции ремиссии пациентов с легкой и умеренной активностью ЯК (индекс активности заболевания 4–10) изучались в похожих по дизайну рандомизированных исследованиях CORE I и CORE II [17–20]. В CORE I сравнивали будесонид ММХ 9 мг и 6 мг с месалазином 2,4 г и плацебо, тогда как в CORE II сравнивались те же дозы будесонида ММХ с будесонидом 9 мг, высвобождающимся в подвздошной кишке, и плацебо. В обоих исследованиях терапия проводилась 8 нед., и первичными точками были клиническая и эндоскопическая ремиссия на 8-й нед. лечения. Ремиссия определялась как индекс активности ЯК ≤ 1 со значением 0 для ректального кровотечения и частоты стула, отсутствие ранимости СО при колоноскопии, и снижение ≥ 1 эндоскопического индекса от исходного значения. В обоих исследованиях клиническая и эндоскопическая ремиссия была достигнута у значительной части пациентов, получавших будесонид ММХ 9 мг (по сравнению с плацебо). В исследовании CORE I ремиссия на 8-й нед. была достигнута у 17,9% пациентов, получавших будесонид ММХ 9 мг, у 7,4% (р=0,01) в группе плацебо и у 12,1% в группе, получавшей месалазин. В исследовании CORE II частота ремиссии к 8-й нед. составила 17,4% у пациентов, получавших будесонид ММХ 9 мг, по сравнению с 4,5% (p=0,005) и 12,6% (p=0,048) в группах, получавших плацебо и будесонид, высвобождающийся в подвздошной кишке, соответственно. Кроме этого, анализ подгруппы в исследовании CORE II показал, что при приеме будесонида ММХ 9 мг существенно большая часть пациентов с левосторонним ЯК достигла клинической и эндоскопической ремиссии, чем при приеме плацебо (17,7% по сравнению с 5,8% соответственно; p=0,03); часть пациентов с распространенным заболеванием, которые достигли клинической и эндоскопической ремиссии, также была больше при использовании будесонида ММХ 9 мг, чем при использовании плацебо (13,8% по сравнению с 0% соответственно), но это различие не было статистически значимым (p=0,10). В исследовании CORE I анализ подгрупп по тяжести заболевания показал, что у пациентов с легким течением ЯК (индекс активности ЯК 4 или 5), которые получали будесонид ММХ 9 мг или плацебо, клиническое улучшение (определялось как снижение ≥ 3 баллов индекса активности ЯК) было достигнуто у 44,4% и 25,0% пациентов соответственно; у пациентов с умеренной активностью заболевания (индекс ЯК ≥ 6 и ≤10) показатели клинического улучшения составили 39,7% и 30,1% соответственно. Более того, частота заживления СО была больше при применении будесонида MMX 9 мг, чем при применении плацебо, у пациентов с проктосигмоидитом (32,4% по сравнению с 19,5% соответственно; p=0,20) и левосторонним ЯК (40,6% по сравнению с 26,5% соответственно; p=0,22). Похожее различие в пользу будесонида ММХ 9 мг наблюдалось у пациентов с распространенным ЯК (16,1% по сравнению с 10,0% при применении плацебо), но это различие также не было статистически значимым (p=0,39). В анализе исследований CORE I и CORE II пациенты, получающие будесонид ММХ 9 мг, достигали клинической и эндоскопической ремиссии в 3 раза чаще, чем при получении плацебо [ОШ 3,3 (95% ДИ 1,7–6,4)]. Будесонид ММХ 9 мг был статистически значимо более эффективен по сравнению с плацебо у нескольких групп пациентов: мужского и женского пола ≤ 60 лет; ранее принимавших месалазин; не получавших месалазин ранее; с легким течением ЯК на исходном уровне; со средней тяжестью ЯК исходно; с проктосигмоидитом; с левосторонним ЯК; с длительностью ЯК ≥ 1 года и ≤5 лет; с длительностью ЯК > 5 лет.
Будесонид ММХ 9 мг для поддержания ремиссии ЯК
Эффективность будесонида ММХ 9 мг для поддержания ремиссии была изучена у пациентов, которые достигли клинической и эндоскопической ремиссии в исследованиях CORE I и CORE II, у пациентов в исследованиях CORE I и II, которые получали дополнительно 8 нед. лечения (будесонид ММХ 9 мг), и открытом исследовании, в котором пациенты были рандомизированы на группы, получавшие будесонид ММХ 6 мг или плацебо в течение 12 мес.; первичная точка эффективности – клиническая ремиссия, которая оценивалась через 1, 3, 6, 9 и 12 мес. Среднее время до рецидива заболевания (определялось как ректальное кровотечение, частота стула более чем 1–2 р./сут или оба этих фактора) составило 181 день в группе плацебо, но не было достигнуто в группе будесонида ММХ (p=0,02); к 12 мес. вероятность рецидива составила 59,7% и 40,9% соответственно. Однако процентное соотношение пациентов, у которых ремиссия поддерживалась в течение 12 мес., не различалось существенно между группами, что, возможно, связано со статистическими недостатками исследования.
Следовательно, польза будесонида ММХ в поддержании ремиссии в настоящее время недостаточно ясна, и необходимо проведение дальнейших исследований [21].
Побочные эффекты
В целом у молекулы будесонида более благоприятный профиль безопасности, чем у I поколения пероральных кортикостероидов, таких как преднизон или преднизолон. Например, в двойном слепом исследовании в течение 10 нед. 176 пациентов с БК, которые получали преднизолон по схеме снижения или будесонид, высвобождающийся в подвздошной кишке, в течение 10 нед., частота побочных явлений, связанных с глюкокортикоидами, была значительно ниже при применении будесонида, чем преднизолона (33% по сравнению с 55% соответственно; p=0,003). Кроме этого, подавление гипоталамо-гипофизарно-надпочечниковой системы, оцениваемое с помощью измерения средней концентрации кортизола в плазме, было существенно выше при применении преднизолона, чем будесонида, высвобождавшегося в подвздошной кишке, через 4 нед. (р<0,001) и 8 нед. (р=0,02). Благоприятный профиль НЯ будесонида ММХ у пациентов с ЯК был показан в исследованиях CORE I и II.Частота НЯ у пациентов, получающих будесонид ММХ 9 мг или 6 мг, составила 57,5% и 58,7% соответственно в исследовании CORE I, 55,5% и 62,5% соответственно – в CORE II. В обоих исследованиях большинство НЯ было легкими или умеренными по интенсивности, частота серьезных НЯ была ниже и схожей во всех группах лечения. Наиболее распространенными НЯ у пациентов, получавших будесонид ММХ, были головная боль, тошнота. В исследованиях CORE I и II частота НЯ, возможно, связанных с ГКС (акне, задержка жидкости, гиперемия, гирсутизм, инсомния, изменение настроения, «лунное» лицо, нарушение сна, образование стрий), была сравнима с таковой для будесонида ММХ 9 мг (10,2%), 6 мг (7,5 %) и плацебо (10,5%). Самыми распространенными НЯ, возможно, связанными с ГКС, при применении будесонида ММХ 9 мг по сравнению с плацебо были изменения настроения (3,5% и 4,3% соответственно) и нарушение сна (2,7% и 4,7% соответственно). В исследовании будесонида ММХ 6 мг в течение 1 года профиль безопасности был сравним с таковым плацебо [22].
Клиническое наблюдение
Больной Б., 22 года. Болен с 2013 г., диагноз «язвенный колит» поставлен при колоноскопии в ГНЦ колопроктологии и подтвержден гистологически в 2013 г. Принимал постоянно месалазин 3 г/сут. Амбулаторно проведена колоноскопия 24.11.2014 г.: язвенный колит, тотальное поражение, минимальная активность. С января 2016 г. отменил прием препаратов 5-АСК. В феврале 2016 г. отметил появление примеси крови в стуле. Возобновил прием месалазина 3 г/сут со слабоположительным эффектом, кровь в стуле сохранялась.
Однако с середины марта 2016 г. состояние ухудшилось, кроме примеси крови в стуле отмечались диарея до 17 р./сут, периодическое повышение температуры тела до 38° С в вечернее время. При колонофиброскопии от 15.03.2016 г. колоноскоп проведен в дистальный отдел восходящей части толстой кишки, заключение: эндоскопическая картина ЯК (тотальное поражение), тяжелая степень активности (рис. 2). При ЭГДС – хронический гастродуоденит с признаками выраженного обострения процесса, дуоденогастральный рефлюкс, недостаточность кардии, Нр+. Самостоятельно увеличил дозу месалазина до 4 г/сут, микроклизмы месалазина 2 г/сут на ночь со слабоположительным эффектом в виде урежения стула до 12 р./сут, примесь крови сохранялась.
![Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006) Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006)](https://www.rmj.ru/upload/medialibrary/fdc/fdce054cd022b9f2e7afc1c307ee002c.png)
18.03.2016 г. поступил на стационарное лечение в ГБУЗ МКНЦ ДЗМ. В общем анализе крови от 18.03.2016 г. отмечались лейкоцитоз (9,6 × 109) с палочкоядерным сдвигом (28%), повышение СОЭ до 26 мм/ч. В биохимическом анализе крови от 18.03.2016 г. отмечались повышение СРБ до 133,37 мг/л, латентный дефицит железа – 5,4 мкмоль/л.
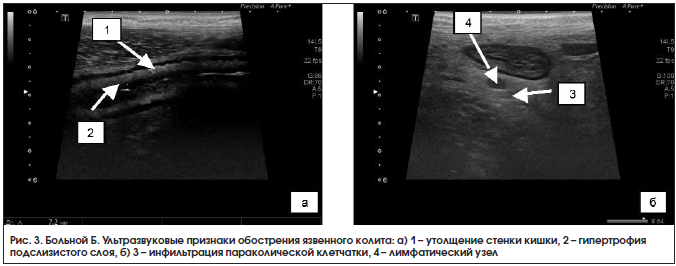
При УЗИ органов брюшной полости 18.03.2016 г.: стенка левых отделов отечная, гипоэхогенная, утолщена до 7–8 мм, гаустрация сглажена, дифференциация слоев прослеживается четко не везде, в просвете – жидкость и изоэхогенное содержимое, в толще стенки – гиперэхогенные включения, что может соответствовать наличию язвенных дефектов; по ходу нисходящего отдела и сигмовидной кишки воспалительная инфильтрация параколической клетчатки с включением л/узлов размером до 11×7 мм; свободная жидкость в правой подвздошной области в небольшом количестве; заключение: эхопризнаки язвенного колита, левостороннее поражение, воспалительная инфильтрация параколической клетчатки по ходу левых отделов ободочной кишки с лимфаденопатией, небольшое количество свободной жидкости в правой подвздошной области (рис. 3). Кальпротектин кала от 19.03.2016 г. – 840 мкг/г.

Установлен диагноз: язвенный колит, тотальное поражение, хроническое рецидивирующее течение, средней степени тяжести, умеренной активности. Латентный дефицит железа.
С учетом отсутствия у больного эффекта от терапии препаратами 5-АСК и категорического отказа от проведения терапии системными ГКС больному назначены Кортимент (топические ГКС) 9 мг/сут, месалазин 5 г/сут, микроклизмы с гидрокортизоном 125 мг 2 р./сут, метронидазол 500 мг 3 р./сут в/в, гидроксид железа 100 мг/сут № 3; цефтриаксон 2,0 г/сут в/в капельно.
На фоне терапии через 10 дней у больного отмечалось улучшение состояния в виде урежения стула до 2 р./сут, без примеси слизи и крови.
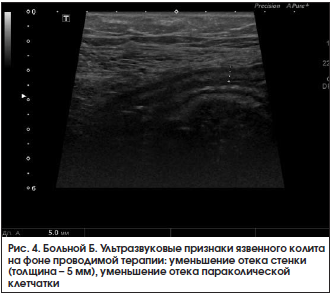
При контрольном УЗИ кишечника 28.03.2016 г.: по сравнению с предыдущим исследованием от 18.03.2016 г. отмечается положительная динамика. Тонкая кишка: петли не расширены, прослеживается ритмичная перистальтика, содержимое – средней эхогенности. Осмотрена ободочная кишка. В проекции слепой кишки, восходящего и поперечного отдела стенки не утолщены (2 мм), дифференциация слоев четкая. В проекции нисходящего отдела и сигмовидной кишки стенки толщиной 2,5–2,7 мм, слоистость стенки сохранена, более выражен подслизистый слой, в толще стенки сохраняются гиперэхогенные включения до 1,5 мм (вероятно, язвы). Клетчатка вокруг умеренно повышенной эхогенности с включением л/узлов размером до 8×3 мм. В правой подвздошной области межпетельно незначительное количество свободной жидкости. Заключение: эхопризнаки язвенного колита, левостороннее поражение, обострение. Мезентериальная лимфаденопатия (рис. 4). В общем анализе крови от 28.03.2016 г. сохраняется повышение СОЭ до 33 мм/ч. В биохимическом анализе крови от 28.03.2016 г. – нормализация уровня СРБ до 3,25 мг/л.
Заключение
Лекарственная формула будесонид ММХ доставляет лекарственное вещество в толстую кишку на всем ее протяжении [23], в то время как другие пероральные формы будесонида с контролируемым высвобождением работают только в дистальной части подвздошной кишки и в восходящей кишке – участках, которые наиболее часто поражаются воспалительным процессом при БК [24].
Будесонид ММХ является эффективным и хорошо переносится при применении с целью индукции ремиссии у пациентов с ЯК легкой и средней тяжести. Имеющиеся в настоящее время данные говорят о том, что этот препарат может быть эффективным и хорошо переноситься для поддержания длительной ремиссии (более 1 года) у пациентов с ЯК [17, 18]. Долгосрочная безопасность ММХ будесонида у пациентов с ЯК сравнима с таковой плацебо, эти данные представлены только в одном исследовании, которое длилось 12 мес. [19]. Однако в нескольких исследованиях изучали применение пероральных форм будесонида в качестве поддерживающей терапии у пациентов с БК, и это подтверждает долгосрочную (до 1 года) безопасность будесонида при поддержании ремиссии ВЗК [25–32]. Применение будесонида ММХ также может быть полезным в фармакоэкономическом плане в связи с возможным повышением приверженности терапии благодаря однократному приему препарата и снижению риска побочных явлений по сравнению с таковым при приеме традиционных пероральных кортикостероидов. Однако необходимо дальнейшее изучение этого препарата у пациентов с ВЗК.
Источник
